A Study of the Protective Effect of Elicitor Protein Isolated from Pseudomonas fluorescens VKPM B-1138 against Viral Pathogens
A Study of the Protective Effect of Elicitor Protein Isolated from Pseudomonas fluorescens VKPM B-1138 against Viral Pathogens
Abstract
Currently, one of the promising directions of biocontrol is the use of a strategy based on the activation of natural defence mechanisms of plants with the help of so-called elicitor proteins. At present, elicitors isolated from plant pathogenic or non-pathogenic microorganisms and represented by oligosaccharides, glycoproteins, peptides and proteins are known. The aim of the work was to isolate the elicitor protein from the biomass of P. fluorescens VKPM B-1138 and to initially evaluate its antiviral activity against PVX and PVY against the background of natural infection of potato tubers under field conditions. To isolate the elicitor protein, R. fluorescens strain VKPM B-1138 was grown in depth in a 100 litre fermentation unit. Initial evaluation against tobacco mosaic virus (TMV) on leaves of tobacco (Nicotiana tabacum L.) cultivar Xanthi showed that treatment of leaves with elicitor protein solution at concentrations of 25.0 and 50.0 mg/L resulted in almost complete 99-100% suppression of TMV. When the protein concentration was reduced 20-fold from 50 to 2.5 µg/ml, the degree of protection decreased to 90%. Field tests of biological activity of elicitor protein of P. fluorescens were carried out in 2022 in Plavskiy district of Tula Oblast. It was established that treatment of tubers and vegetative plants with elicitor protein solution reduced the spread of PVY in leaves by 34.6% and in tubers by 10%. The analysis of experimental and control samples did not detect the presence of PVY virus. Thus, based on the data obtained, it can be assumed that the application of P. fluorescens elicitor protein is able to limit the spread of PVY in field conditions. Nevertheless, the data obtained are not sufficient to draw a definite conclusion about the efficacy of the elicitor protein. Therefore, an extended study of antiviral activity in several climatic zones is expected in the future.
1. Введение
Вирусные и вироидные болезни картофеля представляют особую опасность в связи с вегетативным размножением культуры, при котором инфекция передается через семенные клубни , . Кроме того, они легко передаются от больных растений картофеля к здоровым контактным путем, а также при помощи переносчиков – насекомых, грибов, нематод , . Некоторые фитовирусы, такие, как вирусы картофеля X и Y, моп-топ вирус, вирус скручивания листьев, а также вироид веретеновидности клубней, способны привести к значительным потерям урожая (до 80%) и существенному ухудшению товарных свойств картофеля . Вследствие того, что в отношении ряда вирусов картофеля выполняется правило нулевой толерантности, их обнаружение в посадках или выращенных клубнях семенного картофеля приводит к выбраковке всей партии и значительному финансовому ущербу семеноводов . Эффективных средств противовирусной обработки вегетирующих растений к настоящему моменту не существует; основной мерой борьбы с такими заболеваниями остается уничтожение переносчиков инфекции и тщательный контроль уровня зараженности семенного материала. Следует также отметить, что для разных патогенов этой группы характерны разные переносчики, требующие различных стратегий их контроля, что усложняет необходимые профилактические меры , .
В связи с чем чрезвычайно актуальным является поиск эффективных средств и методов защиты сельскохозяйственных культур от вирусных инфекции . В последние годы одним из наиболее привлекательных направлений представляется стратегия, основанная на активации естественных защитных механизмов растений при помощи так называемых элиситорных белков, стимулирующих развитие у растений индуцированной устойчивости растений , , . Уникальность и привлекательность таких индукторов устойчивости заключается в том, что защитный ответ является неспецифическим и не экспонируется конститутивно, а реализуется только после внедрения патогена. К достоинствам такого метода защиты можно отнести экологическую безопасность, пролонгированный системный ответ, а также минимизацию возможности развития резистентности у патогенов и безопасность сельскохозяйственных рабочих и потребителей сельхозпродукции. Выгодным практическим преимуществом использования биогенных элиситоров является их широкий спектр действия, т.е. индукция неспецифической устойчивости к целому ряду патогенов различной природы .
К настоящему времени исследован довольно широкий спектр элиситоров биогенного происхождения, таких как интактные споры бактерий, фрагменты клеточных стенок микроорганизмов, поли- и олигосахариды, гликопротеины, липиды, органические кислоты, а также белки и пептиды. Однако выведенные к настоящему времени на рынок коммерческие препараты этого класса разработаны главным образом на основе бактериальных культур (Агат-25К, Фитоспорин, Экстрасол, Алирин, Гамаир), хитозана (Хитозар, Нарциссус, Фитохит, Агрохим, Экогель) и органических кислот (Иммуноцитофит, Оберег, Новосил, Циркон, Янтарная кислота). В то же время следует отметить, что пептиды и белки являются важными компонентами иммунной системы растений, участвующими в развитии защитных ответов. Поскольку синтез антимикробных пептидов представляет собой один из наиболее общих защитных механизмов врожденного иммунитета живых организмов, возможность их использования с целью активации механизмов индуцированной устойчивости к фитопатогенам представляется достаточно перспективной. Одним из преимуществ использования белков и пептидов в качестве элиситоров может служить специфичность их действия, связанная с взаимодействием с клеточными рецепторами.
В последние годы был описан ряд белков и пептидов, проявляющих элиситорную активность (различные гликопротеины, флагеллин, фактор элонгации Tu, элиситины и трансглютаминазы видов Phytophthora, харпины и т.п.) , , . Тем не менее вплоть до настоящего времени элиситоры белковой или пептидной природы практически не использовались для производства коммерческих препаратов для защиты растений, что может быть связано с высокой температурной чувствительностью большинства белков и пептидов и необходимостью решения проблемы сохранения активности белковых препаратов в процессе производства, транспортировки и хранения, а также после нанесения на растения.
Анализ данных литературы показал, что штаммы рода Pseudomonas продуцируют широкий спектр соединений (феназины, антибиотики пирролидинового ряда, беталактоны, производные индола, пептиды, гликолипиды, липиды и др.), обладающих антибиотической активностью и способных индуцировать иммунные реакции в растительном организме (SAR или ISR) , , . В связи с чем препараты на основе вторичных метаболитов Pseudomonas spp. могут быть использованы в сельском хозяйстве в качестве эффективных и безопасных агентов биоконтроля.
Учитывая вышесказанное, цель работы состояла в выделении элиситорного белка из биомассы P. fluorescensВКПМ В-1138и начальной оценке ее противовирусной активности по отношению к PVX и PVY на фоне естественного поражения клубней картофеля в условиях поля.
2. Методы и принципы исследования
Объектом исследования являлся элиситорный белок P. fluorescence. Экспериментальная работа состояла из нескольких последовательных этапов. Сначала методом глубинного культивирования в ферментационной установке объемом 100 л была получена биомасса P. fluorescence. Затем из полученной биомассы выделяли элиситорный белок, активность которого оценивали по степени ингибирования ВТМ в опытах in vivo. Полевые испытания биологической активности элиситорного белка P. fluorescence против Х- и Y-вируса картофеля (PVX и PVY) проводили в 2022 г на картофеле сорта Лабадия.
Наработку биомассы P. fluorescence, выделение, очистку элиситорного белка и оценку противовирусной активности проводили в ФИЦ Биотехнологии РАН, г. Москва.
Штамм P. fluorescens ВКПМ В-1138 получен из рабочей коллекции ООО «Алтбиотех». Культуру поддерживали на агаризованной среде следующего состава (г/л): бакто-триптон – 10,0; дрожжевой экстракт – 5,0; хлористый натрий – 10,0; pH 7,0-7,2 при 4ºС в течение месяца с последующим пересевом на свежую среду. Культуру хранили при температуре от (- 20°С) до (- 30°С) в виде 25%-ной глицериновой суспензии в течение 1 года.
Для получения посевного материала P. fluorescence использовали жидкую питательную среду следующего состава (г/л): сахароза – 20,0; мясной пептон – 20,0; KHPO4 – 2,2; MgSO4×7·H2O – 1,0; рН – 7,0 - 7.2. Среду разливали в 500 мл колбы Эрленмейера по 100 мл среды и стерилизовали при 121oС в течение 30 мин. Затем, в колбы с охлажденной средой переносили биомассу P. fluorescence, полученную на агаризованной среде. Колбы помещали на качалочную установку «Innova 44» при 250 об./мин (эксцентриситет 5 см) и выращивали в течение 24 ч при температуре (28±1)°С. Культивирование P. fluorescence вели в ферментационной установке объемом 15 л и рабочим объемом не более 10 л в среде аналогичного состава. Приготовление и стерилизацию питательной среды осуществляли непосредственно в ферментере. Сначала среду в аппарате нагревали до 100-110°С путем подачи в рубашку ферментёра пара давлением 0.28-0.3 МПа. Затем повышали температуру нагрева среды до (121±1) °С. Продолжительность стерилизации – 1 ч. Перед засевом отбирали пробу среды для микробиологического и биохимического контроля. Засев ферментера со стерильной питательной средой, охлажденной до температуры (28 ± 1)°С, производили посевным материалом P. fluorescence, поступающим по посевной линии. Условия культивирования представлены в таблице 1. Через 20 - 24 ч отбирали пробу для контроля стерильности процесса. Полученный посевной материал, объемом 10 л, использовали для засева ферментационной установки объемом 100 л, содержащего 70 л питательной среды аналогичного состава. Культивирование P. fluorescence вели в аналогичных условиях (таблица 1).
Таблица 1 - Условия культивирования в ферментационной установке объемом 15 и 100 л
Параметр | Значение |
температура | (28 ± 1) °С; |
аэрация | от 0 до 4 часов роста – 35 л/мин от 4 часов роста до конца ферментации – 70 л/мин; |
рН среды | не корректируется; |
перемешивание | от 100 до 350 об/мин. При снижении рО2 менее 50% от насыщения - увеличивают обороты мешалки; |
продолжительность культивирования | 20-24 часа |
По окончании ферментации культуральную жидкость сливали в приемник и центрифугировали. Полученную биомассу суспендировали в равноценном объеме 0,05 М калий-фосфатного буфера рН 7.4 с добавлением 2 мМ ЭДТА (в виде двунатриевой соли). Суспензию нагревали на кипящей водяной бане в течение 30 минут, охлаждали и центрифугировали при 10000 об./мин. К полученному супернатанту добавляли (NH4)2SO4 в количестве 40% и выдерживали в течение 12–16 ч при 4-8ºС. Полученный осадок отделяли центрифугированием, промывали 0,05 М калий-фосфатном буфером рН 7.4 и вновь центрифугировали в аналогичных условиях. Полученную белковую фракцию лиофильно сушили. Подлинность элиситорного белка определяли, используя методы электрофореза в полиакриламидном геле.
После лиофилизации навеску белка растворяли в 500 мкл очищенной воды до получения концентрации 2 мг/мл в пересчете на элиситорный белок. Затем, аликвоту раствора объемом 20 мкл смешивали с 10 мкл загрузочного буфера и прогревали при 95°С в течение 5 минут. По окончании полимеризации удаляли гребенку и помещали гель в прибор для электрофореза с добавлением электродного буферного раствора. В соответствующие лунки концентрирующего геля вносили 10 мкл образца и 3 мкл маркера. Напряжение в концентрирующем геле – 90 вольт, в разделяющем – 150 вольт. При достижении фронта основания геля, электрофорез останавливали.
Гель извлекали из ячейки и опускали в большой избыток красящего раствора Кумасси, выдерживая его в течение 1 ч при температуре 50 °С на шейкере 50 об./мин. Предварительно проводили фиксирование геля в фиксирующем растворе в течение 1 ч перед погружением в окрашивающий Кумасси раствор. Обесцвечивали гель избытком обесцвечивающего раствора. Заменяли порции обесцвечивающего раствора несколько раз до тех пор, пока окрашенные полосы белка не стали ясно различимы на прозрачном фоне. После обесцвечивания гель промывали водой и либо высушивали, либо оставляли в воде для хранения при температуре от 2 до 8°С.
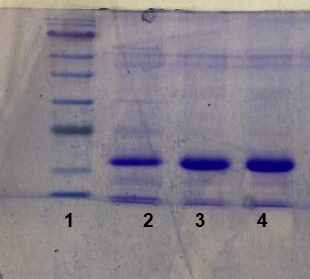
Рисунок 1 - Электрофорез образцов элиситорного белка P. fluorescens
Примечание: 1 – маркеры Blue Ray, 2 – концентрация белка 2 мг/л, 3 - 4 мг/л, 4 – 5 мг/л
Степень защиты определяли по формуле:
где
А – степень защиты, %
No – число некрозов на обработанной раствором элиситорного белка половине листа;
Nk – число некрозов на контрольной половине листа.
Полевые испытания эффективности элиситорного белка P. fluorescence проводили в Плавском районе Тульской области на фоне естественного заражения клубней картофеля Лабадия Х- и Y-вирусами (PVX и PVY) в период 19.05.2022-12.10.2022. Площадь опытной делянки составляла около 50 м2. Схема опыта включала следующие варианты: контроль (без обработки) и опыт (обработка препаратом элиситорного белка). Перед посадкой клубни обрабатывали раствором элиситорного белка (0,28 г препарата/кг клубней). Посадка производилась механизировано. Обработку по вегетации начинали в фазе появления 2–4 настоящих листьев и далее с интервалом 8-12 дней. Всего по вегетации провели 3 обработки. Концентрация элиситорного белка P. fluorescence в первом опрыскивании составила 5 г/50м2, для двух последующих – 7,5 г/50м2. Для обработки использовали ранцевый опрыскиватель «PALISAD». Урожай убирали вручную, путем выкопки клубней со всей площади делянки. Сбор образцов листьев осуществляли перед каждой обработкой. Количество листьев в 1 образце – 3 шт. Закладку опыта, наблюдения и сбор образцов проводили согласно ГОСТ 33996.
Исследования образцов на наличие/отсутствие PVХ и PVY проводились в ООО ИЦ «ФитоИнженерия». Метод испытаний: полимеразная цепная реакция в режиме реального времени по ГОСТ 339961.
Статистическую обработку данных проводили с использованием программы Statistica 6.0 («SoftStat», Inc., США). Определяли среднее стандартное отклонение и стандартную ошибку среднего арифметического. Различия между вариантами, согласно t-тесту, везде, где это не оговорено специально, достоверны при p≥0,05.
3. Основные результаты
В результате серии ферментаций был получен белок P. fluorescens, представляющий собой порошок светло бежевого цвета без постороннего запаха. Для оценки противовирусной активности элиситорного белка P. fluorescens использовали модель ВТМ-некрозообразующий сорт табака Xanthy. Данная модель удобна тем, что позволяет получить точную количественную оценку степени индуцируемой устойчивости путем прямого подсчета числа некрозов на листьях.
Результаты оценки противовирусной активности элиситорного белка P. fluorescens против ВТМ представлены в таблице 2.
Таблица 2 - Влияние обработки листьев табака (Nicotiana tabacum L.) сорта Xanthi растворами элиситорного белка P. fluorescens на образование некрозов при заражении ВТМ
Концентрация (мг/л) | Число некрозов на половинке листа | Степень защиты, % | |
Контроль | Опыт | ||
50 | 83,6±1,1 | 0 | 100 |
25 | 75,6±10,8 | 0,66±0,4 | 99 |
10 | 69,7±10,8 | 2,6±1,7 | 96,2 |
5 | 65,5±13,1 | 3±1,8 | 95,4 |
2,5 | 62,6±13,1 | 6,3±1,5 | 90 |

Рисунок 2 - Результаты обработки листьев табака элиситорным белком P. fluorescens
Примечание: (а) с концентрацией белка 50 мг/л, (б) с концентрацией белка 25 мг/л
Таблица 3 - Анализ образцов листьев картофеля сорта Лабадия на наличие пары вирусов методом ОТ-ПЦР
Образец* | Объём образца, шт. | Количество образцов, шт. | Наличие вируса, % | |
PVY | PVX | |||
Опыт 0 | 3 | 35 | 37,14 | 0 |
Контроль 0 | 3 | 35 | 31,43 | 0 |
Опыт 2 | 3 | 35 | 48,57 | 0 |
Контроль 2 | 3 | 35 | 74,29 | 0 |
Примечание: опыт 0 – отбор проб перед первой обработкой по вегетации;
опыт 2 – отбор проб перед 3-й (заключительной) обработкой по вегетации
Таблица 4 - Анализ образцов клубней картофеля сорта Лабадия на наличие пары вирусов методом ОТ-ПЦР
Образец | Объём образца, шт. | Количество проб, шт. | Наличие вируса, % | |
PVY | PVX | |||
Опыт | 50 | 50 | 72 | 0 |
Контроль | 50 | 50 | 82 | 0 |
Согласно полученным данным, проведенные полевые испытания элиситорного белка P. fluorescens на картофеле сорта Лабадия показали, что обработка клубней и вегетирующих растений раствором элиситорного белка снижает распространение PVY в листьях на 34,6%, (таблица 3), а в клубнях на 10% (таблица 4). В то же время, анализ образцов показал отсутствие вируса PVХ.
4. Заключение
На основании полученных данных, при обработке листьев табака раствором элиситорного белка в концентрациях 25,0 и 50,0 мг/л происходило практически полное 99-100% подавление распространения ВТМ. В полевых условиях при обработке картофеля применение элиситорного белка P. fluorescens ограничивало распространение PVY в листьях на 34,6%, в клубнях – на 10%. Тем не менее для выбора более точной дозировки и кратности обработок в дальнейшем предполагается изучение противовирусной активности белка в нескольких климатических зонах при обработке картофеля и других овощных культур.
