Morphometric and biochemical parameters of Portulaca oleracea L. under salification during cultivation in vitro and hydroponically
Morphometric and biochemical parameters of Portulaca oleracea L. under salification during cultivation in vitro and hydroponically
Abstract
The present research is dedicated to studying the effect of salinity on morphometric parameters and synthesis of secondary metabolites of Portulaca oleraceae during in vitro and hydroponic cultivation. Salinity conditions were created by adding NaCl to nutrient media at concentrations of 25, 50, 100, 200, 300, 400 and 500 mM. The effect on morphometric parameters was evaluated by changes in shoot height, shoot raw and dry biomass, and that of leaves. The total content of phenolic compounds and antioxidant activity were determined spectrophotometrically. It was found that during in vitro cultivation, the shoot height increased with increasing NaCl concentration in the medium (up to 25–100 mM). Increase in raw biomass was observed for plants cultured in vitro and grown on hydroponics with increasing sodium chloride content up to 200 and 100 mM, respectively. The highest content of the sum of phenolic compounds and hydroxycinnamic acids for P. oleracea cultivated hydroponically was found at 25–200 mM NaCl. In vitro plants grown on medium supplemented with 50–200 and 200 mM NaCl also had the highest content of total phenolic compounds and hydroxycinnamic acids, respectively. During in vitro cultivation, the highest level of flavonoids in P. oleracea was observed in the concentrations of 50–200 and 200 mM The stimulating effect of medium and high concentrations of NaCl (100–300 mM) on the antioxidant potential of P. oleracea at different methods of cultivation was identified. Based on the results of the study of morphometric parameters and biologically active compounds, the following optimal NaCl concentrations were recommended: 100 mM for hydroponic cultivation and 200 mM for in vitro cultivation.
1. Введение
Засоление почв негативно влияет на урожайность культур, создавая сложности в обеспечении продовольствием растущего населения. Расширение объема и ассортимента сельскохозяйственных культур за счет растений-галофитов позволит сократить ущерб, вызванный повышением уровня солей в почвах. Галофиты способны выживать и завершать свои жизненные циклы в средах с высокой соленостью, не испытывая серьезных негативных последствий для своего роста или развития. Устойчивость этой группы растений к солевому стрессу обусловлена различными адаптационными механизмами, в том числе, включающими в себя интенсификацию синтеза вторичных метаболитов фенольной природы и антиоксидантов. Таким образом, внедрение галофитов в практику растениеводства позволит также повысить уровень потребления биологически активных веществ и обеспечит более сбалансированный рацион питания населения.
Одним из перспективных растений галофитов является портулак огородный (Portulaca oleracea L.) — однолетнее растение, широко распространенное в тропических и субтропических районах мира, где употребляется в пищу , . P. oleracea является высокопитательной зеленной культурой, богатой витаминами (особенно A и C), минералами (калий, магний, кальций), антиоксидантами и незаменимыми жирными кислотами омега-3 и омега-6 , . В листьях и стеблях P. oleracea отмечается высокое содержание таких вторичных метаболитов, как флавоноиды (апигенин, кемпферол, лютеолин, кверцетин), каротиноиды, стерины, фенольные кислоты (кофейная кислота, п — кумаровая кислота и феруловая кислота) , , .
В последнее время большое внимание привлекают технологии беспочвенного выращивания сельскохозяйственных культур, позволяющие обеспечивать продовольственные потребности, особенно в регионах с плохим качеством почвы или ограниченными пахотными землями. Одной из таких технологий является гидропонное выращивание , . Обогащенные питательными веществами растворы помогают добиться максимальной производительности на единицу площади, а такой ценный в наше время ресурс, как вода, используется с высокой эффективностью . Наряду с различными вариантами гидропонного выращивания растений, все более актуальными становятся разработка и оптимизация технологий культивирования in vitro, которые обеспечивают получение асептического материала, исключая риск заражения патогенами, позволяют строго контролировать условия и четко задавать параметры роста , . При культивировании растений все необходимые вещества содержатся в питательной среде, что и позволяет обеспечить оптимальные условия для их роста и развития, а также адаптировать состав среды в зависимости от специфических потребностей различных видов растений . Кроме того, изменяя состав среды, возможно контролировать и модулировать накопление в растениях различных биологически активных соединений и повышать, таким образом, нутрицевтическую ценность продуктов питания растительного происхождения.
Ранее было показано, что выращивание P. oleracea с применением гидропоники в условиях засоления приводит к повышению уровня фенольных соединений , . Однако, информации о влиянии солевого стресса на рост и другие морфометрические показатели портулака недостаточно для полного понимания его адаптационных механизмов. При этом, отметим, что информация о культивировании портулака in vitro полностью отсутствует. Таким образом, влияние засоления на синтез вторичных метаболитов как в культуре клеток и тканей in vitro, так и при гидропонном выращивании остается важным и актуальным аспектом в изучении P. oleracea. В связи с этим целью настоящего исследования явилось изучение влияния различных концентраций хлорида натрия (25–500 мМ NaCl) на морфометрические (высота побега, сырая и сухая биомасса побегов и листьев) и биолого-химические показатели (суммарное содержание фенольных соединений, флавоноидов, гидроксикоричных кислот и антиоксидантная активность) P. oleracea, культивируемого в условиях гидропоники и in vitro.
2. Методы и принципы исследования
В качестве объекта исследования использовали портулак огородный (Portulaca oleracea L.) сорта Парадокс. При выращивании гидропонным методом, семена портулака высаживали в перлит и поливали ½ питательного раствора Хогланда . Спустя две недели, на стадии четырех настоящих листьев, портулак пересаживали в вегетационный сосуд (по 4 растения) объемом 2 л с питательным раствором. Влияние засоления изучалось с использованием жидкой питательной среды Хогланда с различным содержанием хлорида натрия: 0, 25, 50, 100, 200, 300, 400 и 500 мМ. Аэрация среды осуществлялась компрессором (Hailea ACO 388d). Во время выращивания в теплице поддерживались следующие условия: влажность 70%; день — 22 °С, 16 ч; ночь — 18 °С, 8 ч; фотосинтетически активное излучение 320 мкмоль (м–2с−1). Экспериментальная выборка состояла из 18 вегетационных сосудов (n=3) .
При выращивании in vitro семена портулака обрабатывали H2SO4 (конц) и стерилизовали раствором гипохлорита натрия (содержащего 1–2% активного хлора). Герминация проводилась 14 суток в чашках Петри со средой Мурасиге-Скуга (MS) (pH 5,8), дополненной сахарозой (8 г/л) и агаром (7 г/л) без регуляторов роста.
Для проведения эксперимента использовали проростки длиной 5-10 мм, которые были помещены на 100 мл среды MS (pH 5,8) без регуляторов роста, содержащую 30 г/л сахарозы и 7 г/л агара. NaCl был добавлен в среду в концентрациях 0, 25, 50, 100, 200, 300, 400 и 500 мМ. Культивирование осуществляли в емкостях для культуры тканей Phytohealth (SPL Lifesciences, Республика Корея) по 7 растений в каждом при 25 ± 2 °C с использованием 16-часового фотопериода (белые светодиодные лампы; плотность потока фотосинтетических фотонов 160 мкмоль м−2 с−1). Экспериментальная выборка состояла из 24 культуральных емкостей (n=3).
Растительный материал собирали через 40 дней культивирования in vitro и в условиях гидропоники. Проводили измерения ростовых характеристик: высоты побегов, длины корней, сырой и сухой биомассы побегов, листьев и корней. Растительный материал из каждого сосуда для заданной концентрации NaCl анализировали отдельно (n = 3 для гидропоники и in vitro). Для определения сухой биомассы растительный материал лиофилизировали в течение суток до постоянной массы (Bios BK-FD12S (Китай)).
Сухой растительный материал измельчали до размера частиц менее 0,5 мм. Экстракцию вторичных метаболитов проводили 70% раствором этанола при комнатной температуре в течение 24 часов на орбитальном шейкере (OS-20, Biosan, Латвия). Затем экстракт центрифугировали (6000g, 15 мин); супернатант использовали для дальнейших анализов.
Для определения содержания соединений фенольной природы и антиоксидантной активности использовали мультимодальный ридер (CLARIOstar, BMG Labtech, Ортенберг, Германия). Измерения оптической плотности проводили с помощью плоскодонного 96-луночного планшета.
Количественное содержание фенольных соединений определяли спектрофотометрическим методом с помощью реагента Фолина-Чокалтеу ; общее содержание гидроксикоричных кислот — с реактивом Арно ; содержание флавоноидов — по реакции образования окрашенного комплекса с хлоридом алюминия в присутствии ацетата натрия . Антиоксидантную активность экстракта P. oleracea измеряли по способности захватывать радикалы 2,2-дифенил-1-пикрилгидразил (DPPH) и 2,2′-азино-бис (3-этилбензтиазолино-6-сульфоновой кислоты (ABTS) и восстанавливать Fe (III) в комплексе с 2,4,6-трипиридил-s-триазином (FRAP) в соответствии с .
Статистическую обработку экспериментальных данных проводили с использованием IBM SPSS Statistics 25. Для проверки статистических гипотез и оценки достоверности различий использовали однофакторный дисперсионный анализ (ANOVA) с последующим тестом Тьюки HSD (p ≤ 0,05). Статистические результаты представлены в виде среднего значения ± стандартное отклонение. Разными буквенными индексами на рисунках обозначены статистически значимые различия. На основе нормализованных средних значений анализируемых переменных проводили кластеризацию и построение тепловой карты с использованием программы 2019b (OriginLab Corporation, Нортгемптон, Массачусетс, США). В качестве меры сходства использовалось Евклидово расстояние.
3. Результаты и обсуждение
Для оценки влияния засоления (25–500 мМ NaCl) на морфометрические параметры портулака, культивируемого в условиях гидропоники и in vitro, измеряли высоту побегов, сырую и сухую биомассу побегов, а также сырую и сухую биомассу листьев.
Высота побегов P. oleracea, выращенного гидропонным методом на среде Хогланда с разной концентрацией хлорида натрия, уменьшалась по мере увеличения солености от 0 до 300 мМ NaCl. Максимальная высота побега была характерна для растений из контрольной группы и составила 117,2 ± 5,1 мм. При концентрации 100 мМ NaCl наблюдалось незначительное увеличение данного показателя (103,1 ± 3,1 мм) по сравнению с более низкими концентрациями NaCl (25 и 50 мМ); при концентрациях 200–300 мМ NaCl выявлены явные признаки угнетения роста растений, а на концентрациях 400-500 мМ растения погибли (Рисунок 1а).
В результате эксперимента по оценке засоления растений, культивируемых in vitro на среде MS, были получены следующие результаты: по мере увеличения концентрации соли от 0 до 100 мМ высота побега увеличивалась и достигала максимума при 100 мМ (19,6±2,04 мм). Далее при повышении уровня солености до 300-500 мМ NaCl высота побега начинала уменьшаться и на концентрации 500 мМ NaCl наблюдался минимум — 7,00±3,56 мм (Рисунок 1б).
В результате анализа ANOVA с критерием Тьюки было установлено наличие статистически значимых различий в сырой биомассе побегов P. oleracea, культивируемых в условиях гидропоники на среде с разной концентрацией NaCl (ANOVA, F = 30,17, df1 = 5, df2 = 12, p ≤ 0,001). Сырая биомасса побега увеличивалась по мере увеличения солености от 0 до 100 мМ NaCl. Наибольшая сырая биомасса побега (7,67 ± 1,46 г) наблюдалась при концентрации 100 мМ NaCl (ANOVA, F = 30,17, df1 = 5, df2 = 12, p ≤ 0,001) (Рисунок 1в). При последующем увеличении солености до 200-300 мМ NaCl сырая биомасса побегов резко уменьшалась и достигала минимума – 0,69 ± 0,05 г.
Для растений P. oleracea, культивируемых in vitro, также выявлены статистически значимые различия в значении сырой биомассы побегов (ANOVA, F = 164,9, df1 = 7, df2 = 15, p ≤ 0,001). Как видно из представленных на рисунке 1г данных, сырая биомасса побега увеличивалась по мере увеличения солености от 0 до 200 мМ NaCl. Наибольшая биомасса (0,53 ± 0,024 г) наблюдалась при концентрации 200 мМ NaCl (ANOVA, F = 5,45, df1 = 7, df2 = 92, p ≤ 0,001). Далее при увеличении солености до 300-500 мМ NaCl сырая биомасса побега начинала уменьшаться. На концентрации 500 мМ NaCl значение было минимальным – 0,063 ± 0,008 г.
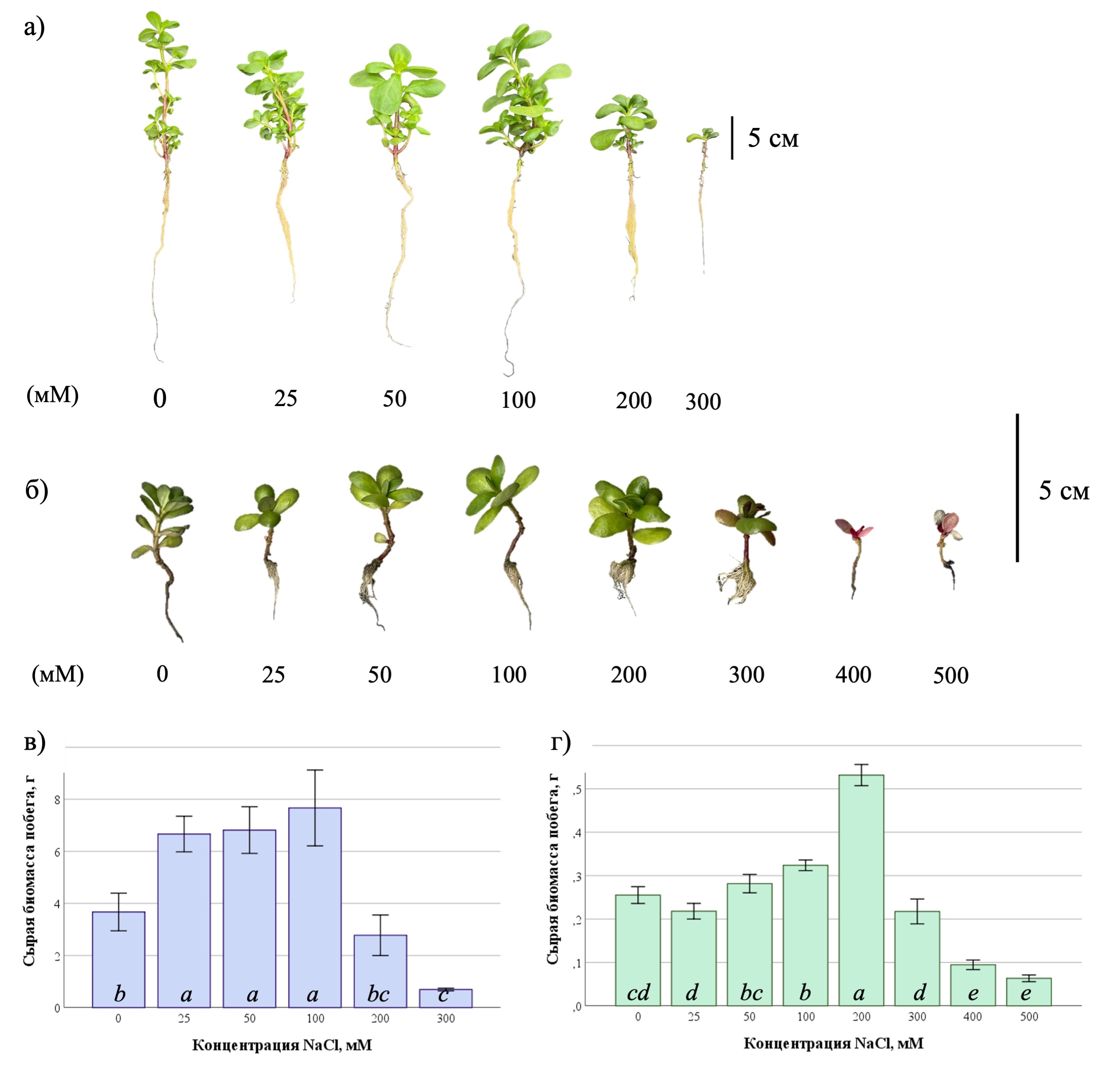
Рисунок 1 - Влияние различных уровней засоления на морфометрические параметры растения P. oleracea:
а – фотография экспериментальных растений, выращенных гидропонным методом; б – фотография экспериментальных растений, культивируемых in vitro; в – показатели средней сырой биомассы побегов растений, произрастающих в условиях гидропоники; г – показатели средней сырой биомассы побегов растений, культивируемых in vitro
Для оценки влияния различных уровней солевого стресса (25–500 мМ NaCl) на содержание фенольных соединений P. oleracea, культивируемого в условиях гидропоники и in vitro, оценивали суммарное содержание фенольных соединений, суммарное содержание флавоноидов и суммарное содержание гидроксикоричных кислот (Рисунок 2).
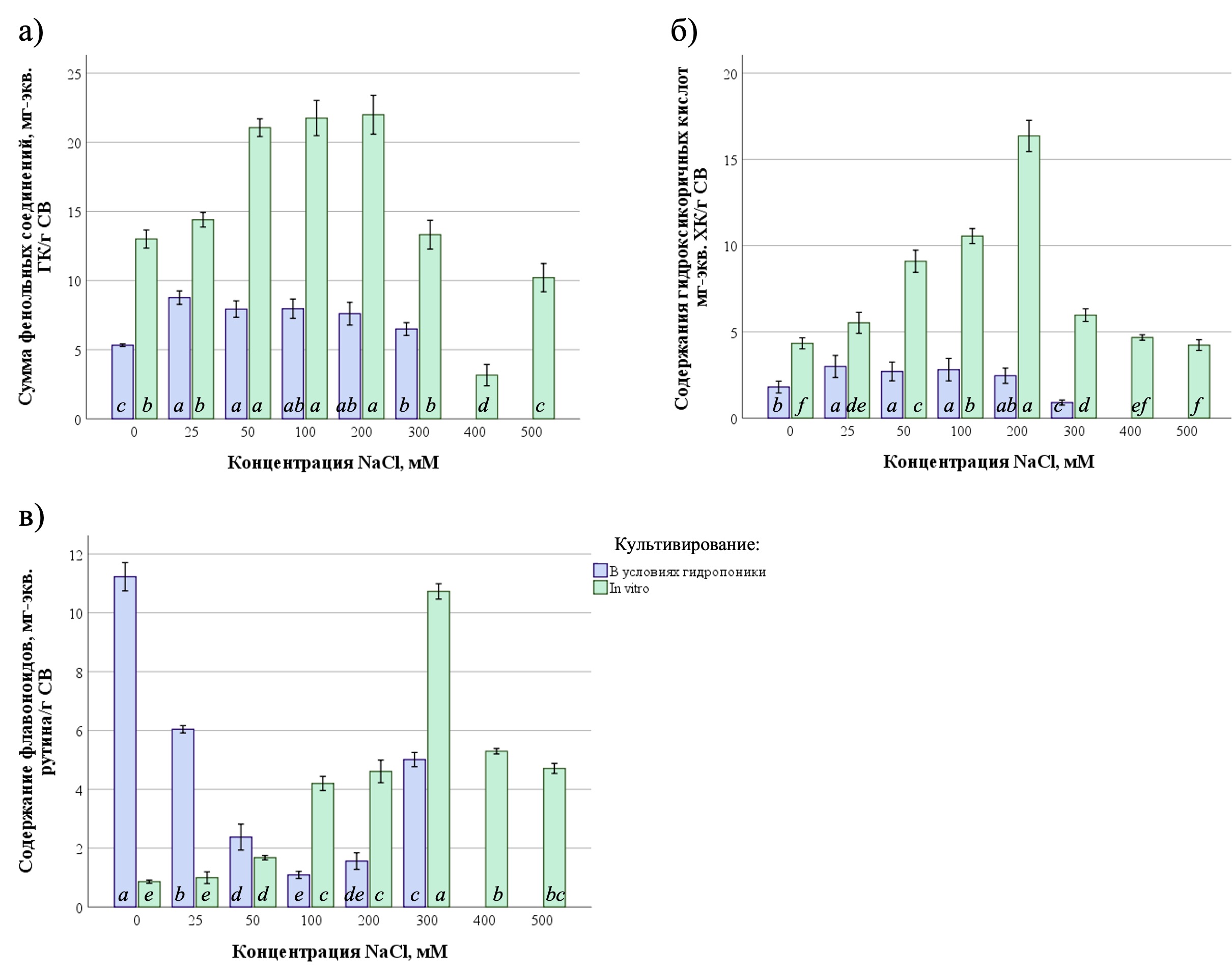
Рисунок 2 - Влияние различных уровней засоления на содержание соединений фенольной природы в растениях P. oleracea, культивируемых на гидропонике и in vitro:
а – сумма фенольных соединений; б – содержание гидроксикоричных кислот; в – содержание флавоноидов; ГК – галловая кислота, ХК – хлорогеновая кислота; СВ – сухой вес
Исследование влияния различных уровней засоления на содержание гидроксикоричных кислот показало, что в условиях гидропоники наибольшее содержание данных вторичных метаболитов наблюдалось при концентрациях 25-100 мМ NaCl (ANOVA, F = 23,1, df1 = 5, df2 = 48, p ≤ 0,001) и составляло 2,7–2,9 мг/г. При культивировании in vitro более высокие показатели по сравнению с контролем получены при добавлении в среду NaCl в концентрациях 25–300 мМ (ANOVA, F = 443,03, df1 = 7, df2 = 43, p ≤ 0,001). Максимальное содержание гидроксикоричных кислот установлено в растениях, культивируемых in vitro при 200 мМ NaCl (16,4 ± 0,9 мг/г).
Также выявлены статистически значимые различия в суммарном содержании флавоноидов P. oleracea, культивируемых в условиях гидропоники (ANOVA, F = 443, df1 = 5, df2 = 12, p ≤ 0,001) и in vitro (ANOVA, F = 654,3, df1 = 7, df2 = 23, p ≤ 0,001). Стоит отметить, что в отличии от других исследованных групп вторичных метаболитов, содержание флавоноидов в P. oleracea, культивируемых в условиях гидропоники, при добавлении в среду NaCl было в 1,9–10,3 раз ниже по сравнению с контрольными растениями. При культивировании in vitro, напротив, сохранялась общая тенденция по стимулирующему действию засоления на содержание флавоноидов. Наибольшее значение было установлено при концентрации 300 мМ NaCl (10,7±0,26 мг/г).
Известно, что увеличение содержания фенольных соединений в ответ на абиотические стрессы является общей стратегией защиты у разных видов растений. Считается, что галофиты, способные произрастать в условиях повышенного засоления, накапливают фенолы и флавоноиды в более высоких концентрациях, чем другие растения, растущие в районах с нормальной соленостью и водными условиями , , . Полученные в нашем исследовании результаты по увеличению содержания отдельных групп вторичных метаболитов фенольной природы в P. oleracea под действием NaCl согласуются с имеющимися в литературе данными. В частности, ранее было показано, что суммарное содержание фенольных соединений и флавоноидов в P. oleracea subsp. oleracea в условиях солевого стресса (100-400 мМ NaCl) было достоверно выше по сравнению с контрольными растениями .
Для оценки влияния различных уровней солевого стресса (25–500 мМ NaCl) на антиоксидантную активностьP. oleracea, культивируемого в условиях гидропоники и in vitro, оценивали антиоксидантную активность методами DPPH, FRAP, ABTS (Рисунок 3)
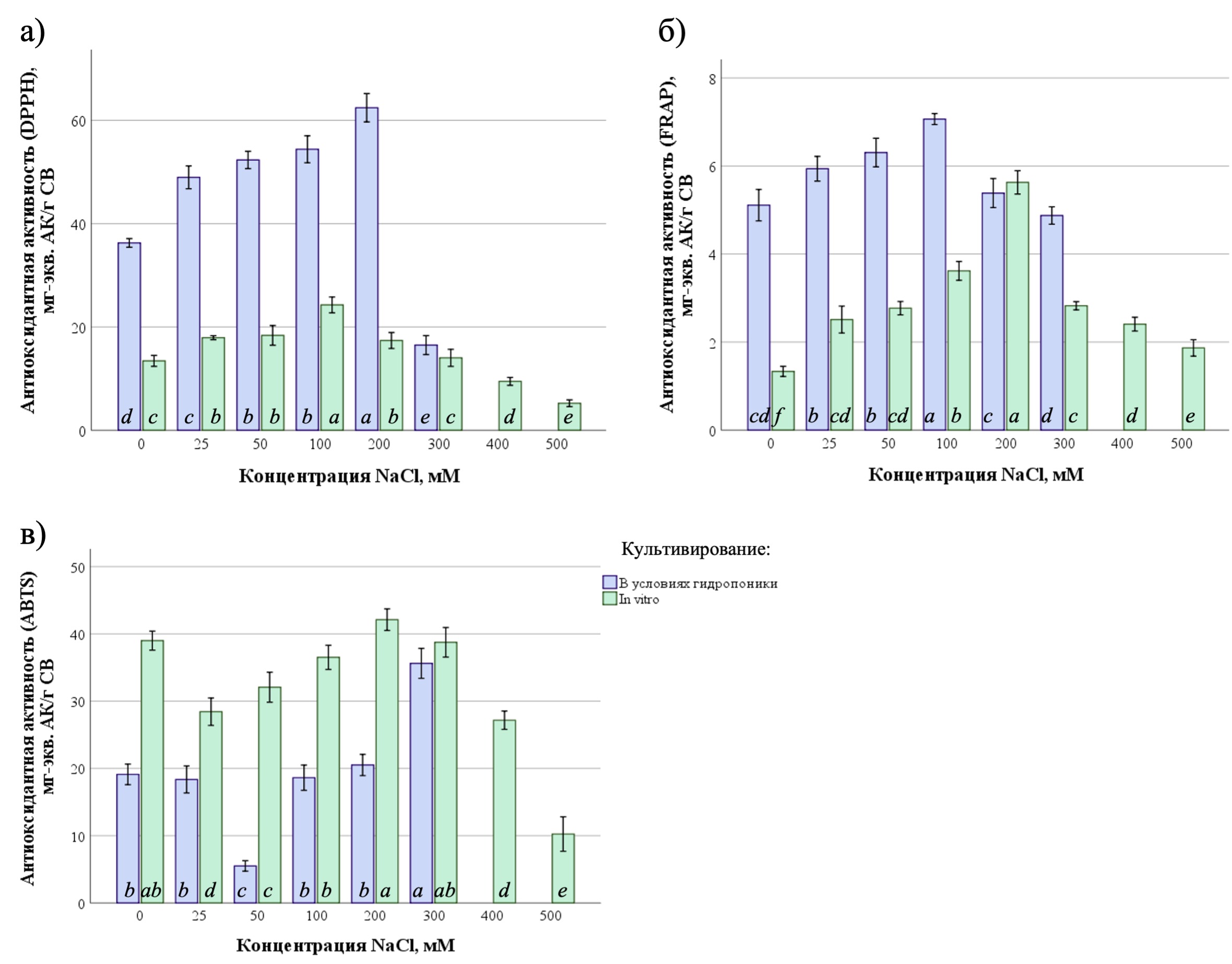
Рисунок 3 - Антиоксидантная активность экстрактов растений P. oleracea, произрастающих в условиях гидропоники и in vitro на питательных средах с разной концентрацией хлорида натрия, определённая методами:
а – DPPH (по способности связывать радикал 2,2-дифенил-1-пикрилгидразила); б – FRAP (по способности восстанавливать Fe (III) в комплексе с 2,4,6-трипиридил-s-триазином); в – ABTS (по способности связывать радикал 2,2′-азино-бис (3-этилбензтиазолино-6-сульфоновой кислоты); АК – аскорбиновая кислота; СВ – сухой вес
В результате проведенных исследований было установлено наличие статистически значимых различий антиоксидантной активности по методу FRAP для растений P. oleracea, культивируемых на средах с разной концентрацией NaCl в условиях гидропоники (ANOVA, F= 76,8, df1 = 5, df2 = 48, p ≤ 0,001) и in vitro (ANOVA, F = 284,3, df1 = 7, df2 = 49, p ≤ 0,001). Антиоксидантная активность при гидропонном выращивании увеличивалась по мере увеличения солености от 25 до 100 мМ NaCl. Наибольшее значение (7,07 ± 0,13 мг-экв. АК/г) наблюдалось при концентрации 100 мМ NaCl (Рисунок 3б). При культивировании in vitro более высоким значением антиоксидантной активности характеризовались растения, культивируемые на средах с добавлением NaCl (25-500 мМ). Наибольшая антиоксидантная активность (5,63 ± 0,26 мг-экв. АК/г) выявлена при 200 мМ NaCl.
Статистически значимые различия в антиоксидантной активности растений P. oleracea, культивируемых в условиях гидропоники (ANOVA, F = 275,9, df1 = 5, df2 = 48, p ≤ 0,001) и in vitro (ANOVA, F = 205,9, df1 = 7, df2 = 49, p ≤ 0,001) установлены также и при использовании метода ABTS. Однако, стоит отметить, что в этом случае достоверное увеличение антиоксидантной активности по сравнению с контролем выявлено только при внесении в среду 300 мМ NaCl и только в условиях гидропонного выращивания.
Считается, что солевой стресс приводит к повышению уровня активных форм кислорода и развитию окислительного стресса . В качестве ответной реакции на это в растениях усиливается биосинтез соединений с антиоксидантными свойствами, и соответственно возрастает антиоксидантная активность. Так, было показано, что в условиях засоления наблюдается повышение антиоксидантный активности нативных растений Portulaca oleracea L., собранных в разных регионах Западной Малайзии . Вместе с тем рядом авторов отмечается, что высокие уровни солевого стресса, как правило более 200–300 мМ, напротив, приводят к снижению антиоксидантный активности, что указывает на возможное ослабление защитных механизмов растения под воздействием высоких концентраций соли . При этом для галофита Ledum decumbens, при его обработке различными концентрациями NaCl (50, 100 и 200 мМ), достоверных изменений антиоксидантной активности по сравнению с контрольными растениями выявлено не было, что может свидетельствовать об устойчивости этого вида к солевому стрессу или о том, что его антиоксидантные механизмы не активируются в ответ на изменения в уровне соли . По результатам, полученным в ходе нашего исследования, выявлены оптимальные концентрации хлорида натрия (100-300 мМ), оказывающие наибольший стимулирующий эффект на антиоксидантную активность экстрактов P. oleracea, что не совсем согласуется с имеющимися в литературе данными. Следовательно, можно судить о том, что реакция антиоксидантный системы на солевой стресс сильно зависит от конкретного вида и сорта растения, а также от продолжительности воздействия стрессового фактора.
На основе нормализованных значений изученных параметров была построена тепловая карта с кластерным анализом (Рисунок 4). Дендрограмма, представленная на рисунке 4 (вверху), демонстрирует, что все изученные параметры можно разделить на два кластера. Первый кластер включает все изученные морфометрические характеристики и антиоксидантную активность по методам DPPH и FRAP. Второй кластер включает общее содержание фенольных соединений, содержание гидроксикоричных кислот и флавоноидов, а также антиоксидантную активность по методу ABTS.
На дендрограмме слева показано, что P. oleracea можно разделить на два больших кластера (Рисунок 4). Первый из них состоит из растений, культивируемых in vitro, а также портулака, выращенного гидропонным методом при концентрации 300 мМ NaCl, а второй — из растений, культивируемых на гидропонике при засолении 0-200 мМ NaCl. Среди растений, выращенных на гидропонике, по результатам кластерного анализа можно выделить группу, которая включала растения, выращенные в диапазоне концентраций NaCl от 25 до 100 мМ. Для этих растений были характерны как более высокие значения морфометрических показателей, так и более интенсивное накопление биологически активных соединений.
Среди растений, культивируемых in vitro, на основе кластерного анализа можно выделить группу растений, выращенных на питательной среде с содержанием NaCl от 50 до 200 мМ. Растения этой группы также характеризовались лучшими ростовыми параметрами и более высоким содержанием вторичных метаболитов фенольной природы.
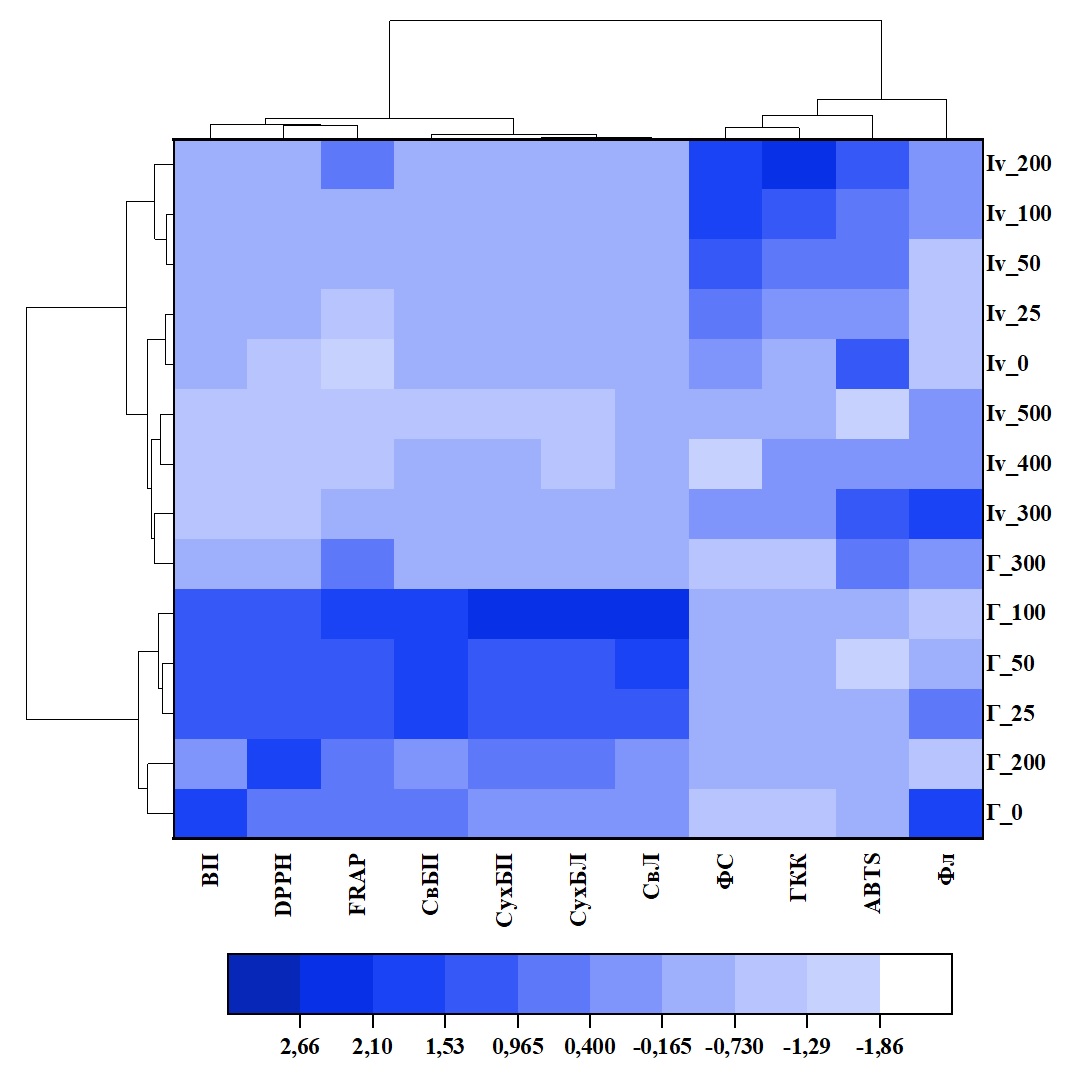
Рисунок 4 - Тепловая карта с кластерами для изучаемых переменных (вверху) и концентраций NaCl для растений, произрастающих на гидропонике и in vitro (слева):
ВП – высота побега; СвБП – сырая биомасса побегов; СвПЛ – сырая биомасса листьев; СухБП – сухая биомасса побегов; СухБЛ – сухая биомасса листьев; ФС – общее содержание фенолов; ГКК – общее содержание гидроксикоричных кислот; ФЛ – общее содержание флавоноидов; DPPH – антиоксидантная активность, определяемая с помощью анализа DPPH (2,2-дифенил-1-пикрилгидразил); ABTS – антиоксидантная активность, определяемая с помощью анализа ABTS (2,2'-азино-бис (3-этилбензотиазолин-6-сульфоновая кислота)); FRAP – антиоксидантная активность, измеренная по способности восстанавливать Fe (III) в комплексе с 2,4,6-трипиридил-s-триазином
4. Заключение
По результатам проведенного исследования было показано, что введение в стандартные питательные среды — Хогланда при гидропонном выращивании и Мурасиге-Скуга при культивировании in vitro — хлорида натрия в различных концентрациях позволяет улучшить как ростовые характеристики, так и питательную ценность P. oleracea за счет увеличения содержания в нем фенольных соединений и антиоксидантной активности. При гидропонном выращивании в качестве оптимальной может быть рекомендована концентрация хлорида натрия 100 мМ, при культивировании in vitro — 200 мМ. Стратегия увеличения содержания соединений фенольной группы и повышения антиоксидантной активности за счет введения в среду хлорида натрия свидетельствует о том, что P. oleracea представляет собой многообещающий объект для разработки функциональных продуктов питания и натуральных антиоксидантов. Это растение, обладая высокой антиоксидантной активностью, может быть использовано в качестве добавки в пищевые продукты для улучшения их питательной ценности и продления срока хранения. Кроме того, его способность адаптироваться к условиям солевого стресса открывает новые возможности для его использования в агрономии и экологии, особенно в условиях изменяющегося климата и увеличения солености почв.
