FEATURES OF MICROSATELLITE LOCI POLYMORPHISM IN SIBERIAN STURGEON OF THE LENA POPULATION BRED UNDER INDUSTRIAL CONDITIONS
FEATURES OF MICROSATELLITE LOCI POLYMORPHISM IN SIBERIAN STURGEON OF THE LENA POPULATION BRED UNDER INDUSTRIAL CONDITIONS
Abstract
The aim of the work was to determine the limits of practical application of microsatellite analysis in the field of breeding work with Siberian sturgeon of the Lena population.
Methods used: polymerase chain reaction, fragment analysis.
Novelty: the data on allelic diversity and species-specific distribution of alleles of microsatellite loci in the Siberian sturgeon of the Lena population grown under aquaculture conditions have been clarified. It was shown that polymorphism of microsatellite loci is capable of marking lines of Siberian sturgeon of the Lena population that have differences in the manifestation of economically useful traits.
Practical significance: the data presented in this work on typical alleles of eight microsatellite loci in different sturgeon species (Siberian, Russian, Sakhalin, Amur sturgeon, Kaluga, Spike, Sturgeon, Sterlet) can be used at fish farms to determine the degree of hybridization. Using the example of the Siberian sturgeon of the Lena population, the methods of identifying species purity and labelling genetic lines that differ in productivity are clearly demonstrated.
1. Введение
Осетровые рыбы представляют собой уникальную группу лучепёрых рыб, объединённых общими чертами морфологии, биологии и экологии. Они являются объектом повышенного внимания в связи с их коммерческой ценностью, благодаря вкусовым качествам продукции (бескостное мясо, икра). По причине своей значимости осетровые стали объектом незаконного вылова и торговли, что привело к снижению численности диких популяций , . В целях сохранения естественных популяций осетровых и обеспечения продукцией населения были разработаны основные принципы искусственного воспроизводства и товарного выращивания данных видов.
Сибирский осётр (Acipenser baerii Brandt, 1869) ленской популяции является одним из наиболее популярных объектов аквакультуры благодаря своему быстрому росту и относительно высокой адаптации к различным условиям разведения (садки, бассейны, пруды).
Одомашненного ленского осетра разводят не только в чистом виде, но и активно используют для получения перспективных межвидовых гибридов, объединяющих полезные качества скрещиваемых видов. В условиях индустриального рыбоводства известны успешные межвидовые скрещивания ленского осетра со стерлядью , с русским осетром («ролик») , с калугой . Возможность получения межвидовых гибридов может иметь и негативные последствия. Так, в целях сохранения особенностей генетической структуры природных популяций конкретного вида, важно знать точное видовое происхождение выпускаемой в естественную среду обитания молоди.
В сравнении с большинством других сельскохозяйственных животных, разведение сибирского осетра и племенная работа с ним начались относительно недавно – необходимость разведения сибирского осетра, как вида, обладающего хорошей икорной продуктивностью, достаточно высокой скоростью роста и крупными размерами возникла по причине катастрофического сокращения в XX веке популяций многих промысловых осетровых видов рыб и необходимостью обеспечить население достаточным количеством товарной продукции, обладающей уникальными гастрономическими качествами. К сожалению, условия, необходимые для восстановления природных популяций большинства видов осетровых в обозримой перспективе не будут восстановлены, поэтому актуальность разведения этих рыб в условиях индустриальной аквакультуры возрастает.
К настоящему моменту в России созданы две породы сибирского осетра – Одомашненная форма (№ 9357522, зарегистрирована в 1993 году) и Лена1 (№ 9463263, зарегистрирована в 2008 году) , причём вторая порода является производной от первой. Донором для этих пород является дикая популяция сибирского осетра реки Лена.
Ввиду позднего полового созревания данного вида рыб (11-22 года) , медленной смены поколений, а также небольшого промежутка времени, прошедшего с момента создания пород сибирского осетра, очевидно, что до сих пор существует возможность существенного повышения хозяйственно-полезных характеристик этой рыбы путём ведения дальнейшей селекционной работы.
Однако, в то время как большинству отраслей животноводства доступен солидный набор разнообразных молекулярно-генетических маркёров, в осетроводстве используют в основном лишь участки митохондриальной ДНК (цитохром b, цитохром-с-оксидаза I, D-петля) , и микросателлитные локусы в контексте подтверждения видовой принадлежности . В этой связи важными представляются задачи по поиску и разработке новых ДНК-маркёров, непосредственно ассоциированных с хозяйственно-полезными признаками этих рыб, а также раскрытию потенциала уже применяющихся методов молекулярной генетики.
Среди ДНК-маркёров, использующихся при работе как с дикими популяциями, так и с аквакультурными стадами сибирского осетра, одно из центральных мест отведено микросателлитным локусам. Микросателлиты (или простые повторы последовательности — SSR) представляют собой тандемные повторы длиной 1-6 п.о. с высоким уровнем вариабельности. Благодаря высокому полиморфизму они очень удобны для изучения генетической дифференциации на различных уровнях (особь, популяция, вид) , .
В настоящее время, при работе с сибирским осетром, микросателлитный полиморфизм применяют в основном для подтверждения видового статуса, оценки уровня генетического разнообразия, а также для выявления генетической дифференциации диких популяций этого вида рыб. Очевидно, что возможности практического применения этого метода для работы с сибирским осетром не раскрыты в полном объёме – микросателлитные профили являются ценным источником информации для ведения селекции благодаря возможности определения степени родства между индивидуальными рыбами, а также степени инбридинга у каждой рыбы. Данные особенности микросателлитных маркёров пока не нашли прямого практического применения в осетроводстве.
В связи с этим, целью настоящего исследования является определение границ практического применения микросателлитного анализа сибирского осетра в области селекционной работы с данным видом рыб.
Для достижения данной цели решали следующие задачи:
- с помощью ранее отобранных нами микросателлитных локусов выявить уровень генетической дифференциации сибирского осетра ленской популяции от других видов осетровых;
- определить величину межпопуляционных генетических различий у сибирского осетра ленской популяции аквакультурного происхождения;
- выявить степень индивидуальной генетической дифференциации у представителей сибирского осетра и сопоставить полученные генетические кластеры с данными индивидуальных измерений рыб.
2. Материалы и методы
Исследования проводили в период 2023-2024 гг. Биологическим материалом послужили фрагменты плавниковой ткани осетровых рыб аквакультурного происхождения.
Образцы ткани русского, сахалинского, амурского осетров, калуги, шипа, севрюги и стерляди были собраны на двух рыбоводных предприятиях: ФГБУ Главрыбвод «Можайский производственно-экспериментальный рыбоводный завод» (Московская область, д. Горетово) и ООО Рыботоварная фирма «Диана» (Вологодская область, рабочий поселок Кадуй) в период плановых бонитировок (см. табл. 1).
Таблица 1 - Исследуемая выборка осетровых видов рыб
Вид/Группа | Обозначение | Кол-во особей | Плоидность | Происхождение |
Сибирский осётр | ABAE 1 | 42 | 4n | Экспериментальная популяция №1 УЗВ ВИЖ им. Л.К. Эрнста, происхождение - МПЭРЗ |
Сибирский осётр | ABAE 2 | 47 | 4n | Экспериментальная популяция №2 УЗВ ВИЖ им. Л.К. Эрнста, происхождение - ООО РТФ "Диана" |
Русский осётр (Acipenser gueldenstadtii Brandt&Ratzeburg, 1833) | AGUE | 22 | 4n | Аквакультура. МПЭРЗ |
Сахалинский осётр (Acipenser mikadoi Hilgendorf, 1892) | AMIK | 10 | 4n | Аквакультура. ООО РТФ «Диана» |
Амурский осётр (Acipenser schrenckii Brandt, 1869) | ASCH | 12 | 4n | Аквакультура. МПЭРЗ |
Калуга (Huso dauricus Georgi, 1775) | HDAU | 6 | 4n | Аквакультура. МПЭРЗ |
Шип (Acipenser nudiventris Lovetsky, 1828) | ANUD | 5 | 2n | Аквакультура. МПЭРЗ |
Севрюга (Acipenser stellatus Pallas, 1771) | ASTE | 20 | 2n | Аквакультура. МПЭРЗ |
Стерлядь (Acipenser ruthenus Linnaeus,1758) | ARUT | 42 | 2n | Аквакультура. МПЭРЗ |
Материалом для изучения генетики сибирского осетра послужили две экспериментальные группы (n1 = 42, n2 = 47; см. табл. 1), содержащиеся в экспериментальной установке замкнутого водоснабжения (УЗВ) ФГБНУ ФИЦ ВИЖ им. Л.К. Эрнста, но полученные на двух разных рыбоводных предприятиях (МПЭРЗ и РТФ «Диана»). Возраст поголовья на момент прибытия в УЗВ составлял 10 месяцев, при средней массе 248,5 г (экспериментальная группа 1) и 327 г (экспериментальная группа 2). Представители обеих экспериментальных групп происходят от разводимого в заводских условиях одомашенного сибирского осетра ленской популяции, при этом принадлежность рыб к какой-либо из двух существующих пород ленского осетра поставщиками рыбопосадочного материала указана не была. Особи сибирского осетра содержались в одинаковых условиях – в круглых рыбоводных бассейнах при температуре 18–20°С, среднее содержание растворенного кислорода составило 10 мг/л, плотность посадки – до 10 кг/м2. Все факторы производственной деятельности, воздействующие на рост и выживаемость осетровых рыб (плотность посадки, гидрохимические показатели, водообмен) поддерживались в пределах нормы.
Для отслеживания динамики темпов роста и развития каждой особи, был присвоен индивидуальный номер при помощи микрочипов Animal ID, которые вводились внутримышечно под 3-4 жучку спинного отдела. Для активации микрочипа использовался сканер РТ-200 (Sails RFID Smart Card Technology Co., Limited, Китай). Эти методы позволили тщательно отслеживать состояние рыб, их рост в условиях экспериментального исследования.
Для вычисления среднесуточного прироста сибирского осетра были использованы следующие показатели: начальная (первая бонитировка) и конечная масса рыбы (через месяц), продолжительность времени (в сутках) между измерениями массы. Среднесуточный прирост (Рср.сут.) вычислялся по формуле :
Рср.сут. = (mк – m0)/t
где mк – конечная масса молоди, г.;
m0 – начальная масса молоди, г.;
t – продолжительность опыта, сут.
Все данные индивидуальных промеров рыб экспериментальных групп, нормы кормления, а также гидрохимические показатели воды занесены в базу данных .
Выделение геномной ДНК проводили с помощью коммерческого набора «Экстран-2» (НПК «Синтол», Россия) по рекомендациям фирмы-производителя. Определение качества ДНК проводили методом электрофореза в 1,2% агарозном геле.
К настоящему времени уже известно большое количество микросателлитных локусов осетровых. Благодаря крайне низким темпам молекулярной эволюции в геномах этих рыб, праймеры, подобранные для одного вида, в большинстве случаев хорошо работают с ДНК других представителей семейства. На основании анализа научной литературы для тестирования исследуемой выборки осетровых рыб, были отобраны 8 STR- маркеров , . Основные характеристики микросателлитных локусов представлены в таблице 2.
Для тетраплоидных представителей осетровых применяли метод подсчета дозы каждого аллеля в микросателлитном локусе, ранее описанный в работе Барминцевой А.Е. , . При стабильном прохождении ПЦР доза каждого аллеля определяется дискретно из расчета, что общее количество аллелей на локус у каждого образца должно быть 4. При этом локус должен обладать полиморфизмом, стабильной амплификацией в ПЦР и не иметь нулевых аллелей. Аналогичный подход к выбору микросателлитных маркеров для генетического анализа осетровых рыб представлен в научной работе .
Таблица 2 - Характеристика тестируемых микросателлитных локусов
Локус | Краситель | Последовательность праймеров |
LS 19 | 6-FAM | F: CATCTTAGCCGTCTGGGTAC |
R: CAGGTCCCTAATACAATGGC | ||
Ag49a | 6-FAM | F: TGTTATCTGCTCTGATATTGATTCG |
R: CGTTTTAAAGTTTGAACGGCA | ||
Agu 37 | R6G | F: ACATGGTAGCAAAATCCCAA |
R: CAGCAAGCTTAGATGCATGG | ||
Agu 41 | ROX | F: AAGACAAACAGTGGCCCAAC |
R: CAATGGCAGGTGCTACTGAA | ||
An20 | 6-FAM | F: AATAACAATCATTACATGAGGCT |
R: TGGTCAGTTGTTTTTTTATTGAT | ||
Agu38 | 6-FAM | F: ACTGGGGTTGAAGGACAGTG |
R: TCCGTCTCATGTCCAAGGGTA | ||
AS043 | 6-FAM | F: *CGACCCTAGAAGGGTTCAGA |
R: TCCTGCAACATGAAGTGAGC | ||
Aru 18 | R6G | F: CCTGGAACACGTCCAGTTTT |
R: TGGGTGAATGTTTTGGTGTG |
ПЦР проводили в конечном объеме 15 мкл. В пробирки вносили по 14 мкл реакционной смеси, состоящей из 1,5 мкл 10½ Turbo-буфера (ЗАО «Евроген», Россия), 1,5 мкл 2 мМ раствора dNTPs, 0,3 мкл 10 мМ смеси праймеров, 1 ед. Smart Таq-полимеразы (ЗАО «Диалат Лтд.», Россия), добавляли ~ 50-100 нг исследуемой геномной ДНК, доводили до конечного объема деионизированной водой. Реакции выполняли на амплификаторе Thermal Cycler SimpliAmp («Thermo Fisher Scientific, Inc», США) в следующем режиме: 10 мин при 94°С (первичная денатурация); 30 с при 95 °С (денатурация), 40 с при 58 °С (отжиг праймеров на ДНК-матрице), 35 с при 72 °С (элонгацию цепей) (38 циклов); 5 мин при 72 °С (финальная элонгация). Электрофоретическое разделение продуктов амплификации проводили в системе капиллярного электрофореза Нанофор 05 (НПК «Синтол», Россия). Размеры аллелей определяли с помощью программного обеспечения GeneMаrker (Version 3.0.1).
Подсчет классических популяционно-генетических параметров: ожидаемой (He) и наблюдаемой (Ho) гетерозиготности, среднего числа аллелей на локус (Na), среднего числа эффективных аллелей (Ne), коэффициента инбридинга (FIS), генетических дистанций по методу M. Nei (1978), индекса Fst выполняли c помощью программы SPAGeDi1-5d. PCA (Principal Coordinate Analysis)-плот был построен на основе вычисления генетических дистанций по методу R. Bruvo с соавторами .
Кластерный анализ по 8-ми видам осетровых рыб проводили с помощью программного обеспечения STRUCTURE 2.3.4 . Особи индивидуально были протестированы на принадлежность к каждому из предполагаемых видов с использованием программного обеспечения STRUCTURE. Значения K в диапазоне от 1 до 10 были протестированы с использованием десяти повторов для каждого значения K, burn-in period составлял 100000 итераций. Поскольку исследуемая выборка включала в себя и диплоидных представителей и тетраплоидных особей, то в процессе подготовки матрицы для анализа, опытным путем было решено к генотипу диплоидных видов (стерлядь, севрюга и шип) по каждому локусу добавлять два нулевых аллеля. Данный подход позволил привести данные для обсчета к единому тетраплоидному варианту и минимизировать ошибку при сравнении генотипов разной плоидности. Частоты аллелей образцов чистых видов были рассчитаны с помощью программного обеспечения SPAGeDi1-5d для исследования встречаемости видоспецифичных аллелей.
3. Результаты и обсуждение
3.1. Видовые особенности полиморфизма микросателлитных локусов у сибирского осетра
Выполненное сравнение полиморфизма длин 8-ми микросателлитных локусов сибирского осетра с другими представителями осетровых позволило получить следующие результаты.
Все выбранные локусы демонстрировали тетраплоидный характер у сибирского (ABAE), русского (AGUE), сахалинского (AMIK) и амурского (ASCH) осетров, обладающих тетраплоидными геномами. Таким образом, для каждого локуса можно подсчитать дозу аллеля. Показатели генетического разнообразия, рассчитанные на основании полиморфизма микросателлитных локусов представлены в таблице 3 – в нашем случае наименьшим генетическим разнообразием обладали выборки шипа, севрюги и сахалинского осетра.
Таблица 3 - Характеристика уровня генетического разнообразия осетровых рыб по 8-ми микросателлитным локусам
Виды | NA | NAE | HE | HO | FIS |
ABAE 1 | 5,13±0,811 | 2,72±0,348 | 0,564±0,084 | 0,609±0,095 | -0,081±0,023 |
ABAE 2 | 8,38±2,464 | 4,46±1,558 | 0,625±0,078 | 0,649±0,075 | -0,04±0,015 |
AGUE | 6,13±1,202 | 3,52±0,797 | 0,608±0,087 | 0,598±0,092 | 0,017±0,045 |
AMIK | 3,00±0,73 | 2,39±0,537 | 0,402±0,134 | 0,435±0,146 | -0,05±0,023 |
ASCH | 8,86±0,498 | 5,50±0,508 | 0,671±0,123 | 0,611±0,157 | 0,091±0,203 |
HDAU | 4,50±1,747 | 3,63±1,139 | 0,559±0,115 | 0,528±0,103 | 0,063±0,049 |
ANUD | 2,38±2,25 | 2,30±1,639 | 0,408±0,13 | 0,317±0,124 | 0,300±0,039 |
ASTE | 2,25±0,313 | 1,92±0,192 | 0,435±0,07 | 0,431±0,1 | 0,009±0,155 |
ARUT | 6,13±1,118 | 3,31±1,028 | 0,451±0,106 | 0,420±0,118 | 0,071±0,106 |
Все | 23,50±5,541 | 8,51±0,81 | 0,796±0,272 | 0,543±0,034 | 0,260±0,038 |
Примечание:
NA — среднее число аллелей на локус; NAE — число эффективных аллелей на локус; HO — наблюдаемая гетерозиготность; HE — ожидаемая гетерозиготность, FIS — коэффициент инбридинга
Были определены наиболее специфичные для каждого вида осетровых аллели микросателлитных локусов и их частоты (см. табл. 4).
В среднем по всем сравниваемым видам наиболее полиморфным локусом является As043 с 46 аллелями, в то время как Aru 18 продемонстрировал наименьший полиморфизм с шестью аллелями в проанализированном наборе данных. Общее количество аллелей для каждого вида варьировало от одного у A. ruthenus и A. nudiventris в локусе Ag49a и до 24 у A. baerii в локусе As043. Частоты аллелей были рассчитаны для идентификации потенциальных частных аллелей, которые можно было бы рекомендовать в качестве диагностических. Распределение частот аллелей указано в таблицах 4 и 5, для каждого из локусов полужирным шрифтом выделены аллели, обладающие наибольшей частотой встречаемости для каждой из тестируемых групп.
Таблица 4 - Распределение аллелей у осетровых рыб в микросателлитных локусах Agu38, An20, Aru18, As043
Локусы | Agu 38 | An 20 | Aru 18 | As043 |
ABAE 1 | 104(0,399)*; 106(0,220); 108(0,024); 110(0,351); 112(0,006) | 155(0,238); 156(0,399); 161(0,012); 163(0,113); 167(0,232); 169(0,005) | 137(0,988); 139(0,006); 143(0,006) | 191(0,036);231(0,006); 246(0,161);254(0,131); 255(0,006);258(0,488); 259(0,024);262(0,137); 266(0,006);271(0,006) |
ABAE 2 | 90(0,011); 104(0,601); 106(0,059); 108(0,165); 110(0,165) | 143(0,075); 149(0,010); 155(0,170); 156(0,015); 157(0,010); 161(0,281); 163(0,106); 164(0,021); 165(0,032); 167(0,229); 173(0,042); 185(0,005) | 137(0,819); 139(0,059); 143(0,096); 145(0,027) | 181(0,005);191(0,005); 238(0,186);246(0,144); 250(0,101);252(0,032); 253(0,011);254(0,080); 256(0,005);258(0,011); 262(0,128);263(0,011); 266(0,202);267(0,016); 271(0,064) |
AGUE | 104(0,432); 106(0,284); 110(0,284) | 159(0,034); 163(0,205); 167(0,182); 171(0,568) | 137(0,966); 139(0,034) | 221(0,023);224(0,114); 228(0,080);234(0,068); 242(0,057);250(0,250); 254(0,034);255(0,023); 258(0,080);262(0,182); 266(0,034);268(0,012); 271(0,045); |
AMIK | - | 161(0,150);181(0,575); 183(0,150); 191(0,025); 195(0,100) | 139/1,00 | 267(0,250);275(0,300); 279(0,325);283(0,125); |
ASCH | - | 125(0,271); 127(0,042); 135(0,333); 141(0,042); 143(0,042); 149(0,021); 151(0,125); 153(0,083); 161(0,042) | 137(0,979); 139(0,021) | 205(0,021);217(0,083); 219(0,021);225(0,042); 227(0,021);234(0,042); 235(0,063);243(0,063); 251(0,021);254(0,021); 255(0,188);263(0,083); 269(0,021);271(0,125); 273(0,042);275(0,021); 277(0,021);279(0,021); 281(0,021);283(0,063) |
HDAU | 116(0,167); 120(0,083); 122(0,333); 124(0,250); 128(0,125); 132(0,042) | 147(0,375); 151(0,042); 165(0,250); 169(0,333) | 137(0,208); 139(0,792) | 231(0,250);247(0,083); 251(0,042);255(0,042); 259(0,167);263(0,083); 267(0,042);279(0,083); 299(0,042);303(0,042); 315(0,125) |
ANUD | 108(0,400); 110(0,600) | 151(0,600); 153(0,200); 163(0,200) | 143(1,00) | 251(0,300);255(0,200); 263(0,100);275(0,100); 279(0,300) |
ASTE | 104(0,275); 108(0,725) | 138(0,475); 142(0,525) | 132(0,475); 139(0,250); 141(0,275) | 238(0,225);250(0,125); 260(0,625);273(0,025) |
ARUT | 104(0,725); 108(0,275) | 146(0,048); 147(0,024); 155(0,036); 158(0,012); 159(0,036); 163(0,083); 166(0,048); 167(0,060); 175(0,548); 176(0,024); 177(0,024); 179(0,060) | 141(0,024); 143(0,881); 145(0,095) | 218(0,083);225(0,107); 231(0,024);238(0,143); 241(0,012);242(0,048); 243(0,095);246(0,119); 250(0,155);254(0,024); 255(0,036); 271(0,155) |
Примечание: в скобках указана частота встречаемости аллелей; полужирным шрифтом выделены аллели с относительно более высокой частотой
Таблица 5 - Распределение аллелей у осетровых рыб в микросателлитных локусах: Ls19, Ag49a, Agu37, Agu41
Локусы | Ls19 | Ag49a | Agu37 | Agu41 |
ABAE 1 | 131(0,571)*; 135(0,423);137(0,006) | 192(0,345);194(0,036);202(0,482);206(0,137) | 124(0,226);126(0,661);128(0,113) | 179(0,101);181(0,012);189(0,315);191(0,345);193(0,107);197(0,119) |
ABAE 2 | 119(0,032);131(0,176);133(0,016);135(0,686);137(0,090) | 192(0,218);196(0,117);202(0,489);206(0,122);218(0,053) | 124(0,043);126(0,766);128(0,191) | 177(0,223);181(0,106); 185(0,043);189(0,367); 191(0,106);193(0,043); 197(0,037);199(0,005); 201(0,069) |
AGUE | 121(0,091);129(0,307);131(0,057);133(0,091);135(0,057);137(0,125)143(0,216);151(0,057) | 196(0,125);198(0,091);200(0,068);202(0,636);204(0,011);206(0,068) | 124(0,591);126(0,295);128(0,034);130(0,034);132(0,045) | 175(0,045);177(0,443); 179(0,079);181(0,330); 183(0,046);185(0,023); 187(0,034) |
AMIK | 125(1,00) | 192(0,475);204(0,200);210(0,200);220(0,025) | 124(1,00) | 181(0,275);193(0,150);195(0,375);197(0,200) |
ASCH | 111(0,042);113(0,063);114(0,063);119(0,167);121(0,521);127(0,021) | 198(0,021);202(0,333);218(0,104);220(0,042);224(0,063);226(0,146);230(0,083);232(0,125);236(0,042);238(0,021);248(0,021) | 114(0,063);120(0,521);122(0,417) | 187(0,042);189(0,063); 195(0,063);197(0,229); 199(0,333);201(0,043); 203(0,083);209(0,042); 211(0,083) |
HDAU | 111(0,250);119(0,750) | 202(0,333);236(0,333);245(0,042);248(0,125);251(0,167) | 122(1,00) | 167(0,042);169(0,667); 171(0,125);177(0,083); 181(0,083) |
ANUD | 121(0,500);129(0,300);131(0,200) | 196(1,00) | 126(0,100);128(0,600);130(0,300) | 181(1,00) |
ASTE | 131(1,00) | 208(0,425); 211(0,575) | 124(0,775);126(0,225) | 183(0,600); 185(0,400) |
ARUT | 134(0,774);135(0,024);137(0,167);141(0,037) | 196(1,00) | 116(0,131);126(0,857);130(0,012) | 181(0,012);185(0,179); 190(0,107);191(0,095); 192(0,119);193(0,274); 194(0,036);195(0,083); 196(0,024);198(0,012); 199(0,036);203(0,024) |
Примечание: в скобках указана частота встречаемости аллелей; полужирным шрифтом выделены аллели с относительно более высокой частотой
На основании распределения аллелей микросателлитных локусов были рассчитаны генетические дистанции между исследуемыми выборками осетровых (см. табл. 6).
Таблица 6 - Значения генетических дистанций, Nei (1978) между видами осетровых рыб
Виды | HDAU | ASCH | ARUT | ABAE2 | AGUE | ABAE1 | ANUD | ASTE | AMIK |
HDAU | 0,2443 | 0,4720 | 0,3436 | 0,3414 | 0,3824 | 0,4601 | 0,4598 | 0,3685 | |
ASCH | 0,2443 | 0,3666 | 0,1749 | 0,1619 | 0,1927 | 0,3425 | 0,3905 | 0,3715 | |
ARUT | 0,4720 | 0,3666 | 0,2735 | 0,3621 | 0,3671 | 0,3038 | 0,4656 | 0,4953 | |
ABAE2 | 0,3436 | 0,1749 | 0,2735 | 0,1363 | 0,0801 | 0,3715 | 0,3771 | 0,3916 | |
AGUE | 0,3414 | 0,1619 | 0,3621 | 0,1363 | 0,1511 | 0,3576 | 0,3767 | 0,3484 | |
ABAE1 | 0,3824 | 0,1927 | 0,3671 | 0,0801 | 0,1511 | 0,4302 | 0,3746 | 0,4116 | |
ANUD | 0,4601 | 0,3425 | 0,3038 | 0,3715 | 0,3576 | 0,4302 | 0,4874 | 0,4721 | |
ASTE | 0,4598 | 0,3905 | 0,4656 | 0,3771 | 0,3767 | 0,3746 | 0,4874 | 0,3955 | |
AMIK | 0,3685 | 0,3715 | 0,4953 | 0,3916 | 0,3484 | 0,4116 | 0,4721 | 0,3955 |
Как и ожидалось, генетическая дистанция между экспериментальными группами сибирского осетра оказалась наименьшей из всех сравниваемых групп и составила 0,0801. По результатам межвидовых сравнений наименьшие различия выявлены между сибирским и русским осетрами (от 0,1363 до 0,1511 в зависимости от выборок сибирского осетра, см. табл. 6). Наибольшая генетическая дистанция получена при сравнении сахалинского осетра и стерляди (0,4953, см. табл. 6) – данный результат также является вполне закономерным – стерлядь относится к атлантической филогенетический кладе осетровых, сахалинский осётр – к тихоокеанской . Значительная генетическая дистанция отмечена между стерлядью и калугой (0,4720), также относящейся к тихоокеанскому филогенетическому кластеру. Крайне низкая генетическая дистанция отмечена нами между выборками русского и амурского осетров (0,1619, см. табл. 6), относящихся к разным филогенетическим кладам – данный результат, скорее всего, свидетельствует о недостаточной эффективности применяемых конкретных микросателлитных маркёров для выявления генетической дифференциации этих двух видов.
Были выполнен расчет формирования генетических кластеров в тестируемой выборке осетровых рыб на основании коэффициента подобия Q (анализ выполнен в программе STRUCTURE) (см. рис. 1). Кластеризация позволила корректно отнести каждую особь к своему виду, что говорит о том, что данный тип расчетов имеет высокие перспективы для определения чистоты вида/гибридного происхождения.
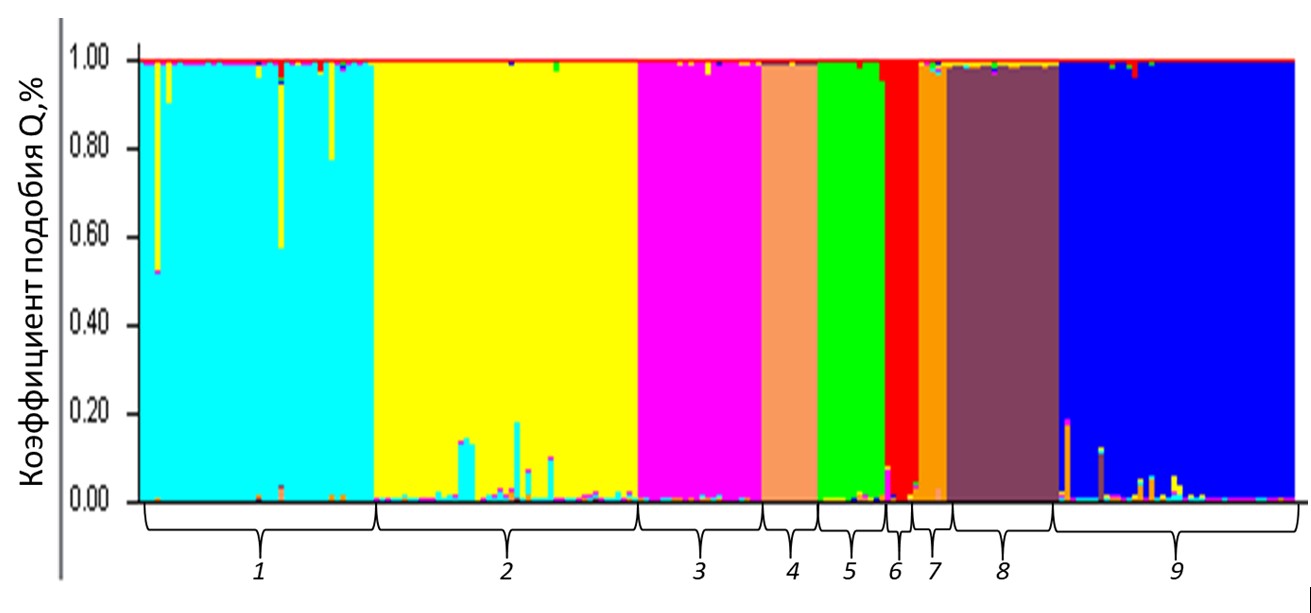
Рисунок 1 - Кластерный анализ выборки осетровых видов рыб на основании частот аллелей по 8-ми микросателлитным локусам, выполненный с помощью программы Structure 2.3.4 для числа кластеров K=9
Примечание: Q- величина вклада каждого из кластеров в генотип особи (вероятность того, что особь принадлежит к тому или иному кластеру): 1- ABAE 1, 2- ABAE 2, 3- AGUE, 4- AMIK, 5- ASCH, 6- HDAU, 7- ANUD, 8- ASTE, 9- ARUT
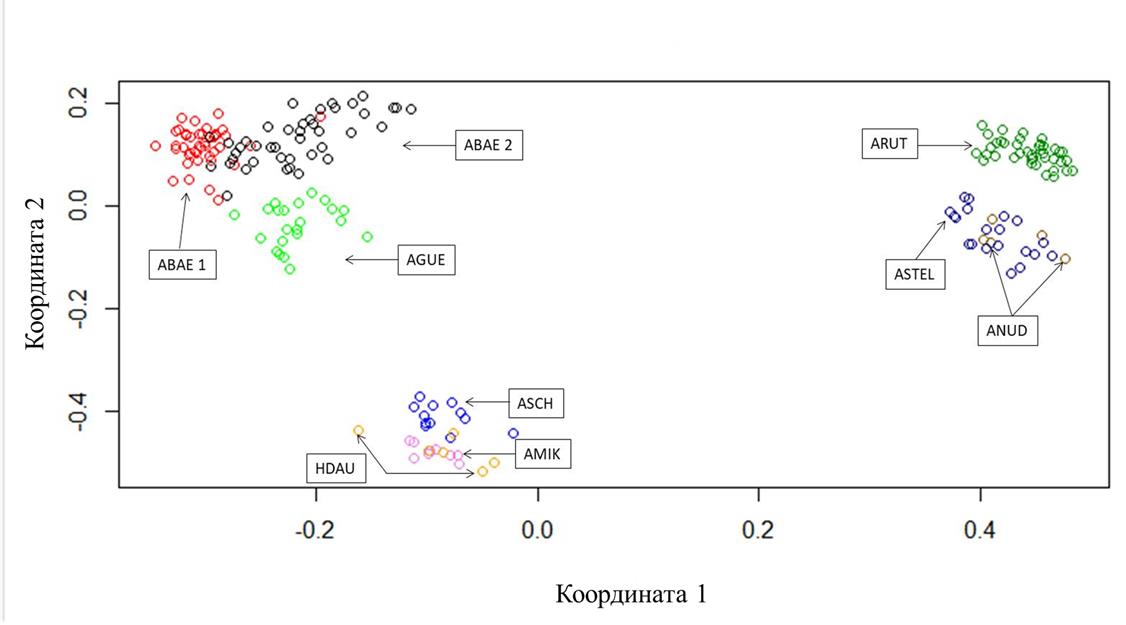
Рисунок 2 - Локализация особей осетровых рыб в пространстве двух измерений на основании их генотипов по 8-ми микросателлитным локусам
Примечание: cокращенные обозначения осетровых видов рыб см. в таблице 1
У данных сравниваемых групп почти во всех микросателлитных маркёрах присутствуют одинаковые аллели, но в разных соотношениях. К примеру, в локусе Aru 18 аллель 137 п.о. встречается у 90% представителей двух видов, аналогично в локусе Agu 37 представлены аллели 124 п.о. и 126 п.о. Исключением является маркёр Ls 19 – для сибирского и русского осетров характерен аллель длиной 131 п.о., однако, у русского осетра в 60 % случаях наблюдается аллель 127 п.о., который полностью отсутствует у представителей сибирского осетра. Аналогичные результаты описаны и в работах других авторов , , где исследователи отмечают схожесть микросателлитных аллелей русского и сибирского осетров.
Используя обширный набор локусов, в данном исследовании мы старались определить чёткие видоспецифичные, и при этом распространённые с высокой частотой встречаемости аллели, дифференцирующие эти два вида. Однако, выбранные для исследования микросателлитные локусы не обладают подобными аллелями, и видовая идентификация в данном случае возможна только при выделении кластеров на основании коэффициента подобия Q (см. рис.1), формируемого по совокупности частот аллелей тестируемых образцов.
Ввиду распространенности на осетровых заводах гибрида «ролик» (гибрид русского осетра и сибирского осетра ленской популяции) необходим дальнейший поиск более надёжного ядерного маркёра для идентификации событий гибридизации. Так, в случае использования материнской линии русского осетра при гибридизации этих двух видов, найденные ранее межвидовые митохондриальные различия могут быть малоинформативны, т.к. фенотип русского осетра является доминантным по большинству признаков. При дальнейшем снижении доли кровности сибирского осетра (скрещивании гибрида с русским осетром) повышается вероятность ошибок визуального определения гибридной рыбы, а также кластеризации по рассмотренным нами микросателлитным локусам (ввиду отсутствия видоспецифичных мономорфных аллелей).
При гибридизации сибирского осетра с другими видами осетровых, микросателлитные маркёры должны проявлять значительно более высокую разрешающую способность за счет разницы в диапазонах длин аллелей рассмотренных микросателлитов (см. табл. 4, 5).
3.2. Особенности внутривидового полиморфизма микросателлитных локусов у сибирского осетра
Внутривидовые различия между двумя протестированными аквакультурными экспериментальными группами сибирского осетра проявились в следующих особенностях. В целом, микросателлитные локусы сибирского осетра в обеих аквакультурных популяциях имели одинаковый аллельный состав. Однако, в локусе Agu 38 в группе ABAE 2 был обнаружен аллель 90 п.о., который наблюдался у нескольких особей этой группы. Кроме того, микросателлитный маркёр Ls19 показал наличие аллеля 119 п.о. у особей сибирского осетра из популяции ABAE2. Маркёр An 20 имел полиморфный характер, аллельный набор составлял для первой группы (ABAE1) – 6 аллелей на локус, а для второй – 12, при этом число эффективных аллелей оказалось равным 3,59 и 5,65 соответственно.
В локусе Aru 18 обнаружен аллель 137 п.о., который практически единообразно присутствует у рыб разных экспериментальных групп. Наблюдается высокая частота встречаемости аллеля 266 п.о. в локусе As043 у выборки сибирского осетра из экспериментальной группы 1 (ABAE 1), одновременно аллель 258 п.о. является специфичным для второй исследуемой группы.
Полиморфизм аллелей микросателлитных локусов позволяет обнаружить наличие явной генетической дифференциации в аквакультурных стадах сибирского осетра ленской популяции (экспериментальные группы были получены с двух разных рыбоводных хозяйств), соответственно, рассмотренный в настоящей статье набор микросателлитных маркёров может применяться для генетической паспортизации аквакультурных стад сибирского осетра ленской популяции.
3.3. Индивидуальная дифференциация представителей сибирского осетра ленской популяции при помощи профилей микросателлитных локусов
Полученные микросателлитные профили были использованы для получения индивидуальных генетических дистанций и выстраивания кластеризации представителей внутри каждой из экспериментальных групп на основе родственных связей по принципу: чем меньше различий в генетическом профиле, тем выше предполагаемая степень родства (табл. 7).
Таблица 7 - Характеристики экспериментальных групп
Характеристики \ экспериментальные группы | Группа 1 | Группа 2 |
Значение минимальной генетической дистанции | 0,060 | 0,085 |
Значение максимальной генетической дистанции | 0,633 | 0,696 |
Среднее значение генетической дистанции | 0,237 | 0,287 |
Средняя живая масса на начало эксперимента, г | 248,5 | 327 |
Среднесуточный прирост между двумя бонитировками, г / сут. | 0,95 | 1,85 |
% погибшей рыбы во время акклиматизации | 21,4 | 2,1 |
На основании индивидуальных генетических дистанций с помощью метода UPGMA для каждой из двух групп было выстроено дерево генетических взаимоотношений (см. рис. 3, 4).
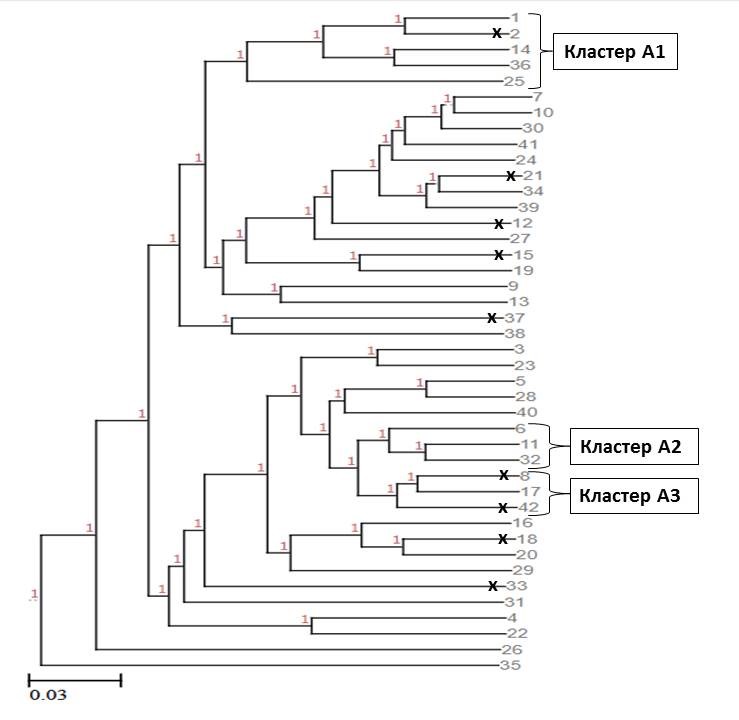
Рисунок 3 - Дендрограмма индивидуальных генетических взаимоотношений представителей экспериментальной группы 1
Примечание: кластер А1 – особи с низкими показателями живой массы; кластер А2 – особи с высокими показателями живой массы на начало эксперимента; кластер А3 – особи с высоким % смертности; знаком «х» отмечены рыбы, погибшие в процессе адаптации к условиям УЗВ
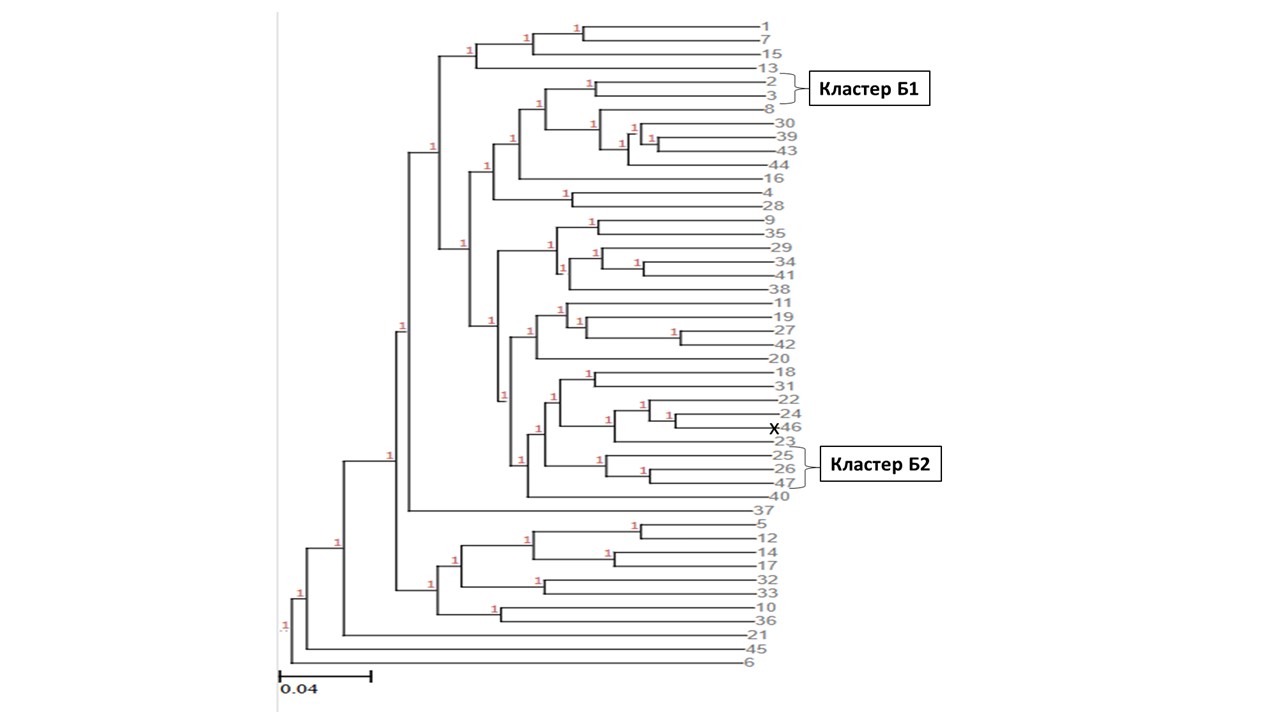
Рисунок 4 - Дендрограмма индивидуальных генетических взаимоотношений представителей экспериментальной группы 2
Примечание: кластер Б1 – особи с низкими показателями среднесуточного прироста; кластер Б2 – особи с низкими показателями живой массы на начало эксперимента; знаком «х» отмечены рыбы, погибшие в процессе адаптации к условиям УЗВ
Рассматривая особенности генетической кластеризации группы 1 (рис. 3), можно выделить кластер А1, объединяющий рыб с низкой живой массой на начало эксперимента (живая масса в кластере колебалась от 181 г до 223 г, средняя живая масса в кластере = 200,4 г), кластер А2, включающий в себя рыб, обладающих высокой живой массой на начало эксперимента (живая масса в кластере колебалась от 238 г до 323 г, средняя живая масса рыб в кластере = 293,7 г) и кластер А3, состоящий из трёх особей, две из которых погибли во время акклиматизации.
В дендрограмме генетических взаимоотношений группы 2 (рис. 4) можно выделить кластер Б1, включающий рыб с низким среднесуточным приростом живой массы (среднесуточный прирост колебался от -0,63 г/сут до 0,56 г/сут), при этом из трёх рыб во всей экспериментальной группе, обладающих наименьшим среднесуточным приростом, две находились в данном кластере. Выделяется кластер Б2, содержащий рыб с низкой живой массой на начало эксперимента (живая масса в кластере колебалась от 209 г до 314 г, средняя живая масса в кластере = 250,4 г).
Известно, что за редким исключением , полиморфизм микросателлитных локусов не влияет на проявление каких-либо фенотипических и физиологических признаков. Наблюдаемые в данном исследовании тенденции кластеризации, вероятнее всего показывают влияние на продуктивность и адаптационные характеристики генетики конкретных производителей, участвовавших в нерестовой компании. Микросателлитный анализ позволил выявить внутри экспериментальных стад кластеры, выделенные на основании генетического сходства, часть из которых имела контрастные характеристики по накоплению живой массы и выживаемости. Таким образом, применение генетического анализа на осетровых хозяйствах позволит существенно ускорить работу по выведению линий сибирского осетра, дифференцированных по проявлению хозяйственно-полезных качеств.
4. Заключение
В силу существенных различий в диапазонах длин аллелей, описываемых микросателлитных локусов, полученные с их помощью генетические профили имеют перспективы для выявления чистоты вида/гибридного происхождения сибирского осетра, за исключением гибридизации с русским осетром, для надежной идентификации которой необходим дальнейший поиск генетических маркёров. Рассмотренные в данной работе микросателлитные маркёры позволяют отчётливо выявлять генетическую дифференциацию в аквакультурных стадах сибирского осетра ленской популяции и могут быть применены в целях генетической паспортизации в сфере аквакультуры. До момента разработки методов высокопроизводительного генотипирования, специализированных на геноме сибирского осетра, микросателлитный анализ имеет перспективы применения в качестве инструмента маркирования генетических линий сибирского осетра ленской популяции, отличающихся характеристиками продуктивности и адаптационными способностями.
