Study of the efficiency of inhibition by Lactobacillus species strains of pro-inflammatory cytokine production by human epithelial cells of Caco-2 induced by Campylobacter jejuni
Study of the efficiency of inhibition by Lactobacillus species strains of pro-inflammatory cytokine production by human epithelial cells of Caco-2 induced by Campylobacter jejuni
Abstract
The study evaluated the effects of lactobacilli on the expression levels of proinflammatory cytokines in Caco-2 cells induced by Campylobacter jejuni. Five species of bacteria of the genus Lactobacillus: L. crispatus, L. gasseri, L. fermenrum, L. reuteri and L. plantarum were used to determine the efficiency of inhibition of pro-inflammatory cytokine production by Lactobacillus strains. Intrleukin-1 alfa (Il-1a) and interleukin-6 (Il-6) were selected as target cytokines. Il-1a is synthesized by many cells in the body and causes fever and is responsible for controlling leukocyte activity and increasing the number of bone marrow cells, which can lead to joint degeneration. Interleukin 6 is one of the most important mediators of the acute phase of inflammation. Accumulation of this cytokine leads to an increase in body temperature, has a stimulating effect on the synthesis of acute phase proteins by the liver, stimulates proliferation and differentiation of B- and T-cells, as well as leukocytopoiesis. Excess production of Il-6 leads to tissue damage due to autoimmune reactions. The housekeeping gene hBD-1 (human b-defensin) was used as a reference. The expression of this protein is constitutive and is not regulated by pro-inflammatory stimuli or bacterial invasion. Co-incubation of Caco-2 culture with C. jejuni and this microorganism showed a decrease in the expression of Il-1a and Il-6 in infected cells to the values corresponding to the control. It was experimentally established that when Caco-2 cells were co-incubated with C. jejuni and L. crispatus, Il-1a expression was reduced 220-fold compared to control C. jejuni-induced cells, and Il-6 expression was reduced 900-fold. It is proved that L. fermentum strain does not affect the expression levels of the studied interleukins, while L. reuteri microorganism strain contributes to the reduction of cytokines up to 2000 times. It is shown that the presence of L. plantarum leads to a decrease in the synthesis of Il-1a in the induced culture to normal levels, but the most effective in terms of inhibition of pro-inflammatory cytokines was shown to be the strain of L. gasseri.
1. Введение
Продукты промышленного птицеводства относятся к наиболее распространенным в большинстве стран. Эти продукты являются основным источником инфицирования людей кампилобактериями , , . У цыплят, выращенных в условиях промышленного птицеводства, отсутствует колонизационная резистентность кишечника в отношении комменсалов Сampylobacter , , . Эти микроорганизмы вызывают у человека диарею и многочисленные серьезные осложнения. Высокая антигенная изменчивость Сampylobacter снижает эффективность вакцин и свидетельствует о необходимости разработки альтернативных методов борьбы с патогеном , . В качестве альтернативы антибиотикам используются пробиотики , , . В предыдущих наших работах были произведены исследования по отбору перспективных лактобацилл, антагонистичных к Campylobacter jejuni – виду грамотрицательных бактерий, который является наиболее распространенным и более патогенным для человека . Во всем мире кампилобактериозом ежегодно болеют более 400 миллионов человек . В ходе исследования были получены штаммы молочнокислых бактерий – Lactobacillus crispatus ВКМ В-2727Б, L. gasseri ВКМ В-2728Б, L. fermentum ATCC 9338, L. reuteri ATCC 23272, L. plantarum ATCC 8014 и L. plantarum MD IIE-2165 , , , .
Цитокины представляют собой секретируемые или представленные на мембране молекулы, которые определяют широкие клеточные функции, включая развитие, дифференцировку, рост и выживание. Соответственно, регуляция активности цитокинов чрезвычайно важна как физиологически, так и патологически .
Различают провоспалительные и противовоспалительные цитокины (IL-2, IL-10, IL -27, IL -35 и IL -37), а также обладающие двоякими свойствами (например, IL -6). Кроме того, выделяют регуляторные цитокины, которые обеспечивают толерантность к собственным тканям, минимизацию тканевого повреждения. Координированная выработка элементами иммунной системы различных цитокинов происходит в непосредственной близости к клеткам-мишеням , , .
Противовоспалительные цитокины представляют собой серию иммунорегуляторных молекул, которые контролируют провоспалительную цитокиновую реакцию. Цитокины действуют совместно со специфическими ингибиторами цитокинов и растворимыми рецепторами цитокинов, регулируя иммунный ответ. Их физиологическую роль в воспалении и патологическая роль в системных воспалительных состояниях все больше изучают. Основные противовоспалительные цитокины включают антагонист рецептора интерлейкина (IL)-1, IL-4, IL-6, IL-10, IL-11 и IL-13. Специфические цитокиновые рецепторы IL-1, фактора некроза опухоли-α и IL-18 также действуют как ингибиторы провоспалительных цитокинов , .
2. Материалы и методы
Для определения эффективности ингибирования штаммами лактобацилл продукции провоспалительных цитокинов применяли пять видов бактерий рода Lactobacillus: L. crispatus, L. gasseri, L. fermenrum, L. reuteri и L. plantarum. Культивирование лактобактерий осуществляли на классической среде MRS при температуре 25±2оС.
Для культивирования клеточной линии аденокарциномы толстой кишки человека Caco-2 использовали среду DMEM (Sigma -Aldrich, Великобритания) с добавлением 10% фетальной бычьей сыворотки. Культивирование осуществляли в увлажненной атмосфере с добавлением 5% CO2 при 37±2оC. Для проведения эксперимента клетки 20 пассажа при плотности 1x104 клеток/мл высеивали на 24-луночные планшеты для тканевых культур и выращивали до достижения 90% конфлюэнтности.
Культивирование патогенной бактерии Campylobacter jejuni проводили на колумбийском кровяном агаре, содержащем 5% лошадиной крови при 37±2оC в микроаэрофильных условиях.
Инокулумы бактерий получали путем посева 5–10 колоний суточной культуры с чашки Петри в жидкую питательную среду MRS для лактобактерий и бульон Бруцелла для C. jejuni и последующего культивирования при оптимальных температурах до OD 600 равной 0,5.
Для оценки влияния лактобактерий на экспрессию провоспалительных цитокинов в эпителиальных клетках, индуцированных C. jejuni, подготовленные планшеты с клеточной линией Caco-2 инкубировали в течение 5 часов с добавлением 1 мл клеточной культуры C. jejuni, а также ко-культур C. jejuni и лактобактерий при стандартных условиях. По истечении времени инкубирования бактерии удаляли, и клеточный монослой трижды промывали средой DMEM.
Эксперимент проводили в 3 повторностях. Клетки замораживали в жидком азоте и хранили при 80±2оC для последующего выделения РНК и анализа экспрессии. В качестве контроля использовали чистую культуру Caco-2.
Транскрипты целевых генов получали путем выделения тотальной РНК из индуцированных клеток с проведением реакции обратной транскрипцией. Выделение тотальной РНК проводили с помощью коммерческого набора RNeasy Mini Kit (Qiagen. Германия) по протоколу производителя.
Для получения кДНК применяли набор реактивов MMLV RT kit (ООО «Евроген», Россия) с использованием праймера олиго(dT) при синтезе первой цепи. Концентрацию полученной оц-ДНК измеряли с помощью флуориметра Qubit 2.0 (Thermo Fisher Scientific, США). Подбор праймеров к 3’ и 5’ нетранслируемым участков транскриптов осуществляли с помощью программы CLC Genomics Workbench.
Уровни экспрессии транскриптов определяли методом полуколичественной ПЦР в реальном времени с использованием прибора BioRad CFX96 (США). Детекцию накопления продуктов реакции проводили путем добавления в реакционную смесь интеркалирующего красителя SybrGreen. Для амплификации использовали готовую реакционная смесь qPCRmix-HS SYBR (ООО «Евроген», Россия). Амплифицию к ДНК проводили в объеме 20 мкл по протоколу производителя в двух повторностях. Параметры циклирования представлены в таблице 1.
Таблица 1 - Параметры циклирования при амплификации целевых транскриптов
Этап | Стадия | Температура инкубации, оС | Время, сек |
1 | Предварительная денатурация | 98 | 30 |
2 | Денатурация | 98 | 30 |
3 | Отжиг | 57 | 30 |
4 | Элонгация | 72 | 60 |
Снова 2 этап 29 (34) раз | - | - | - |
5 | Финальная элонгация | 72 | 300 |
Для анализа результатов использовали метод относительной оценки экспрессии 2^∆∆Ct, заключающийся в выявлении различий экспрессии в контрольном и экспериментальном образцах. Вычисления осуществлялись в программе CFX Manager.
В результате исследования оценены эффекты влияния лактобактерий на уровни экспрессии провосполительных цитокинов в клетках Caco-2, индуцированных C. jejuni. В качестве целевых цитокинов выбраны интрлейкин-1 alfa (Il-1a) и интерлейкин-6 (Il-6). Il-1a синтезируется многими клетками организма и вызывает повышение температуры, а также отвечает за контроль активности лейкоцитов и увеличение количества клеток костного мозга, что может приводить к дегенерации суставов. Интерлейкин 6 является одним наиболее важных медиаторов острой фазы воспаления. Накопление данного цитокина приводит к повышению температуры тела, оказывает стимулирующее действие на синтез белков острой фазы печенью, стимулирует пролиферацию и дифференцировку B- и T-клеток, а также лейкоцитопоэз. Избыточная продукция Il-6 приводит к повреждению тканей вследствие аутоиммунных реакций. В качестве референсного использовали ген домашнего хозяйства hBD-1 (человеческий b-дефенсин). Экспрессия данного белка является конститутивной и не регулируется про воспалительными стимулами или бактериальной инвазией.
Последовательности праймеров оценки экспрессии данных транскриптов представлены в таблице 2.
Таблица 2 - Последовательности праймеров
Целевой ген | Последовательность |
Il-1a F: | ATG GCC AAA GTT CCA GAC ATG |
R: | TTG GTC TTC ATC TTG GGC AGT CAC |
Il-6 F: | CAT CCT CGA CGG CAT CTC AG |
R: | GCT CTG TTG CCT GGT CCT C |
hBD-1 F: | CTCTGTCAGCTCAGCCTC |
R: | CTTGCAGCACTTGGCCTTCCC |
3. Результаты исследований
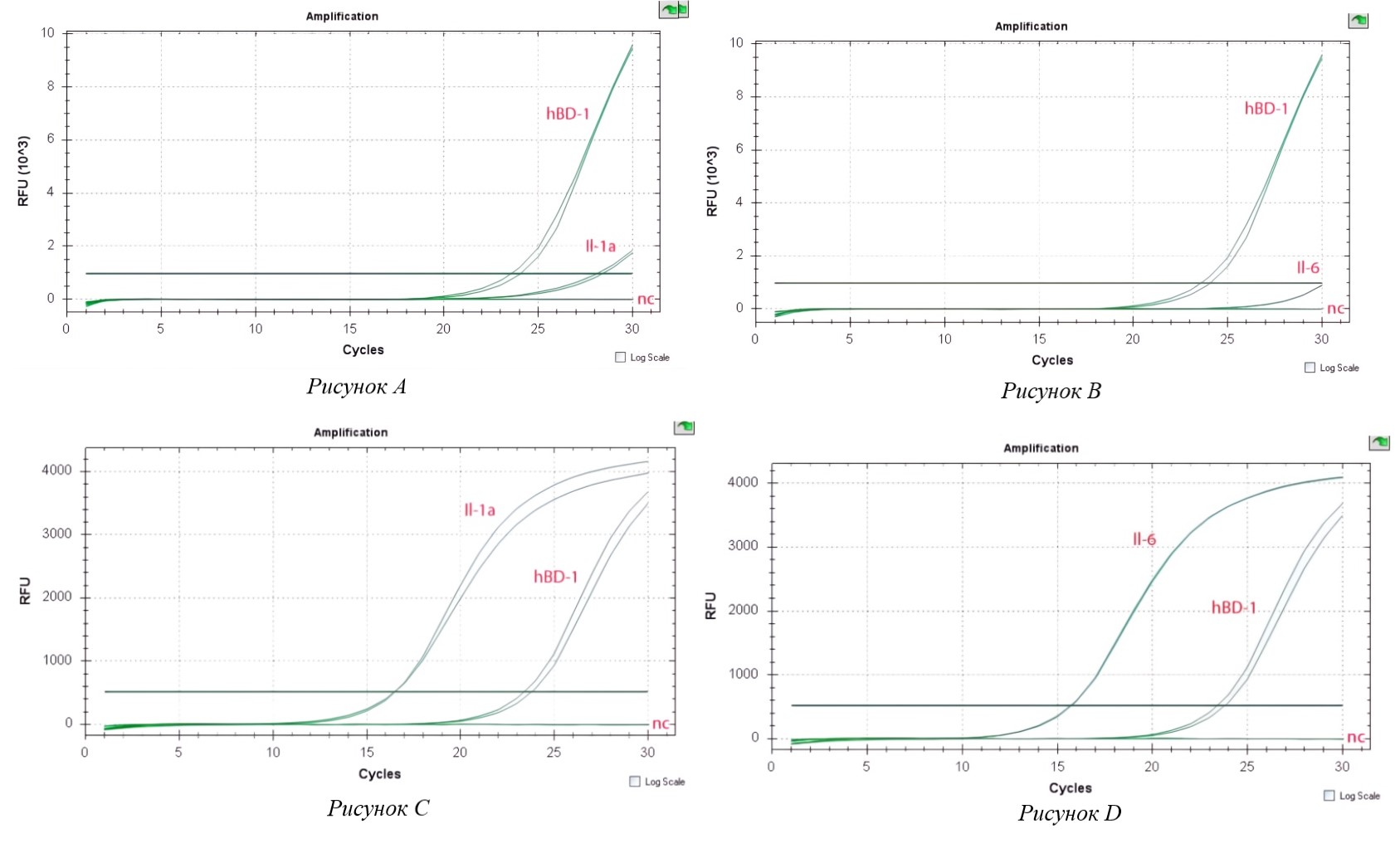
Рисунок 1 - Экспрессия провоспалительного цитокина (А–D)
Примечание: (А) – Экспрессия провоспалительного цитокина Il-1a в контрольных (не индуцированных) клетках Caco-2;
(B) – Экспрессия провоспалительного цитокина Il-6 в контрольных (не индуцированных) клетках Caco-2;
(C) – Экспрессия провоспалительного цитокина Il-1a в клетках Caco-2, индуцированных C. jejuni;
(D) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni
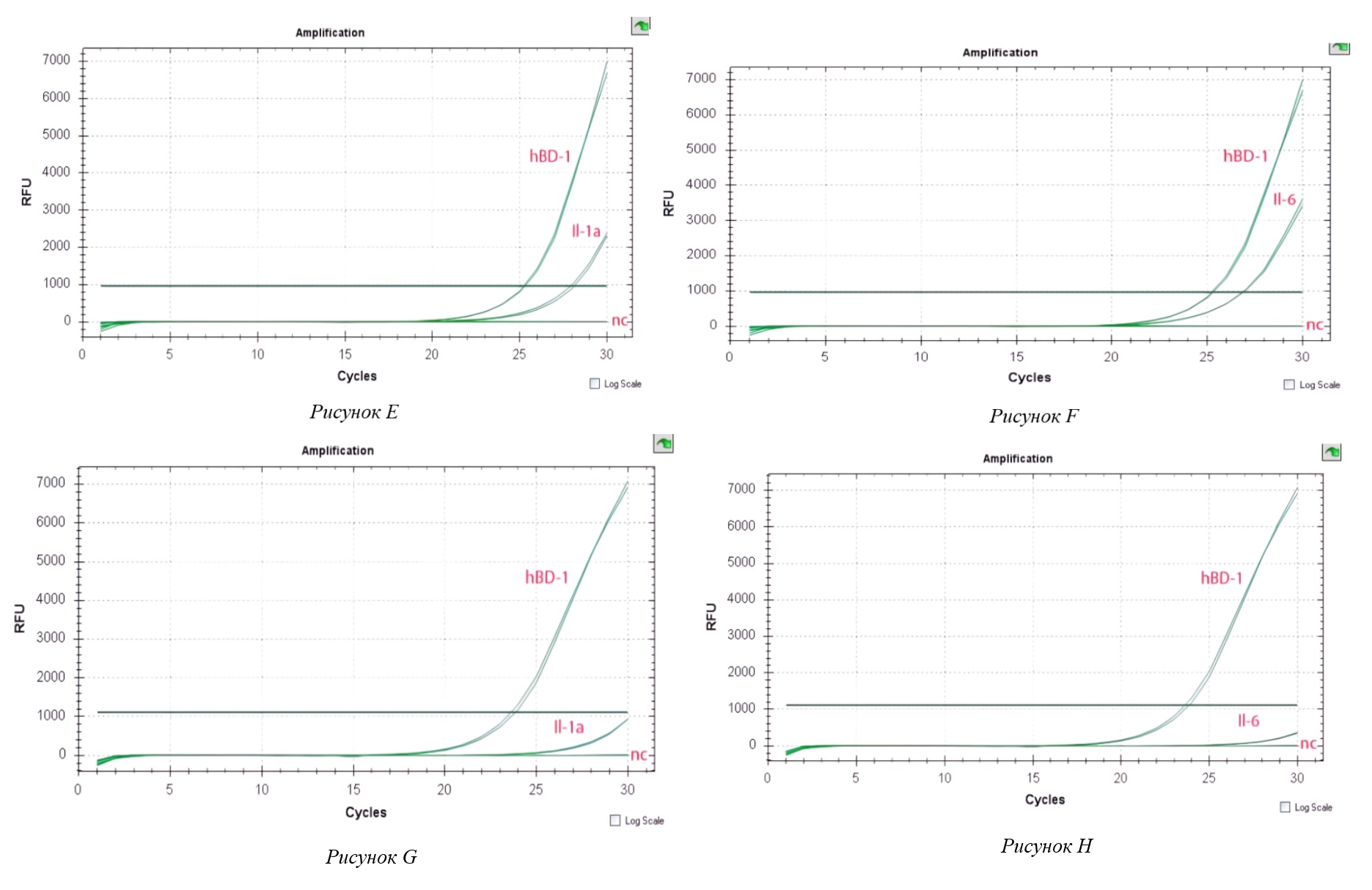
Рисунок 2 - Экспрессия провоспалительного цитокина (E–H)
Примечание: (E) – Экспрессия провоспалительного цитокина Il-1а в клетках Caco-2, индуцированных C. jejuni при совместном инкубировании с L. crispatus;
(F) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. crisparus
(G) – Экспрессия провоспалительного цитокина Il-1а в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. gasseri;
(H) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. gasseri
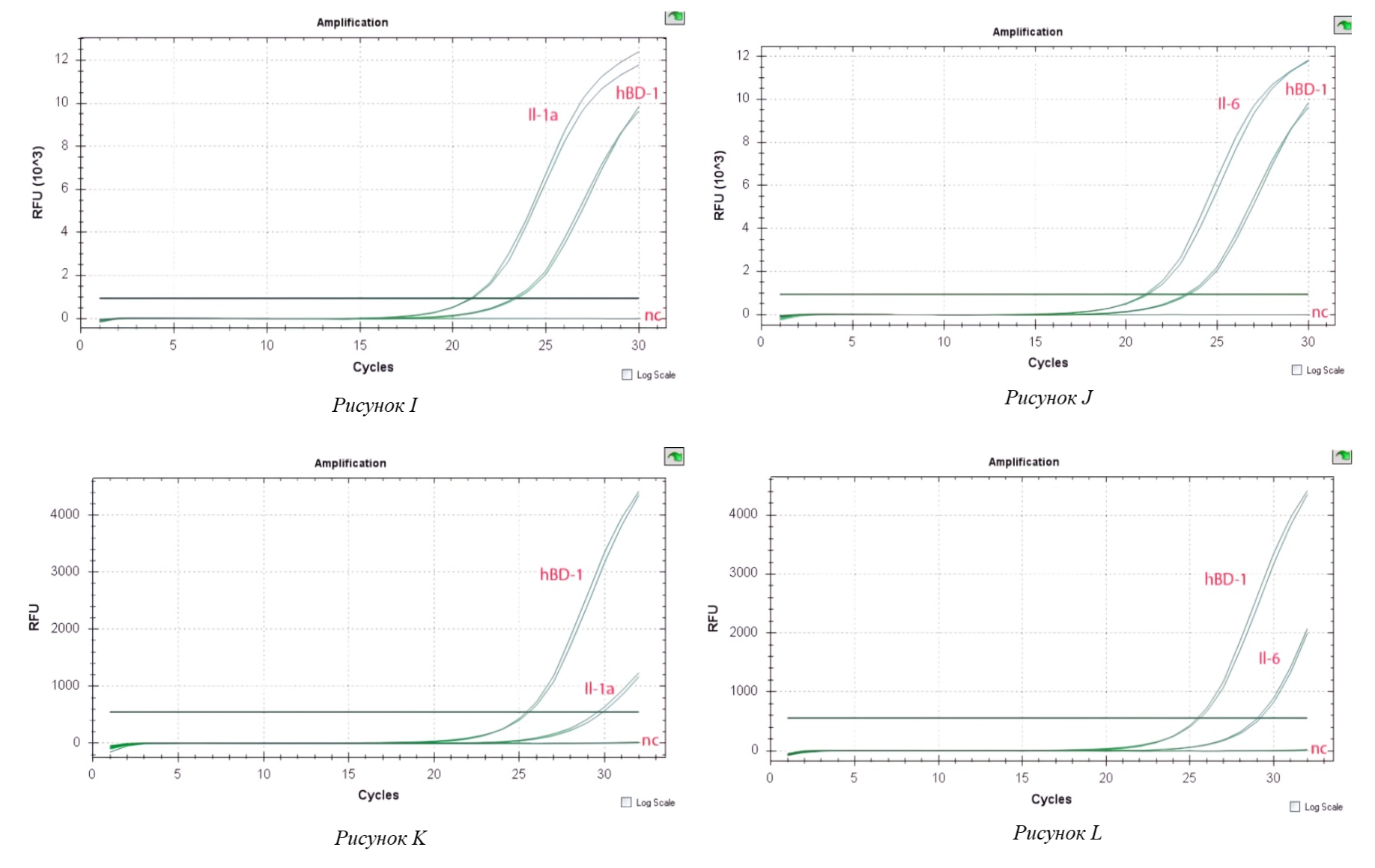
Рисунок 3 - Экспрессия провоспалительного цитокина (I–L)
Примечание: (I) – Экспрессия провоспалительного цитокина Il-1а в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. fermentum;
(J) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкуб.с L. fermentum;
(K) – Экспрессия провоспалительного цитокина Il-1a в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. reuteri;
(L) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. reuteri
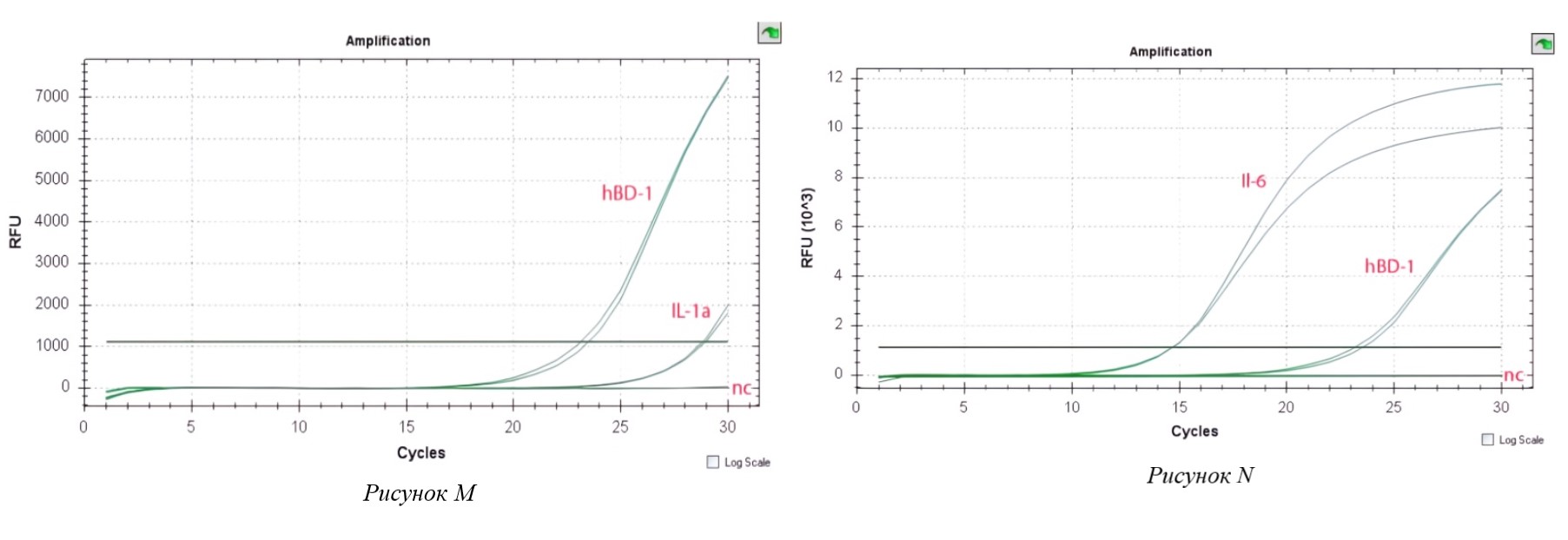
Рисунок 4 - Экспрессия провоспалительного цитокина (M–N)
Примечание: Экспрессия провоспалительного цитокина Il-1a в клетках Caco-2, индуцированных C. jejuni при совместном инкуб. с L. plantarum;
(N) – Экспрессия провоспалительного цитокина Il-6 в клетках Caco-2, индуцированных C. jejuni при совместном инкубировании с L. plantarum
4. Заключение
Таким образом, в ходе проведенного исследования, была изучена эффективность ингибирования штаммами лактобацилл Lactobacillus crispatus, L. gasseri, L. fermentum, L. reuteri, L. plantarum, L.s plantarum продукции провоспалительных цитокинов эпителиальными клетками человека Caco-2, индуцированной С. jejuni. Установлено, что при совместном инкубировании клеток Caco-2 с C. jejuni и L. crispatus экспрессия Il-1a снижается в 220 раза по сравнению с контрольными индуцированными C. jejuni клетками, а экспрессия Il-6 снижается в 900 раз. Доказано, что штамм L. fermentum не влияет на уровни экспрессии изучаемых интерлейкинов, а штамм микроорганизма L. reuteri способствует снижению цитокинов до 2000 раз. Показано, что, присутствие L. plantarum приводит к снижению синтеза Il-1a в индуцированной культуре до нормальных уровней, но наиболее эффективной с точки зрения ингибирования провоспалительных цитокинов показал себя штамм L. gasseri.
