Study of polymorphisms in the coding part of paralogic genes of insulin-like growth factor 2 (IGF2) in sterlet (Acipenser ruthenus, Linnaeus, 1758)
Study of polymorphisms in the coding part of paralogic genes of insulin-like growth factor 2 (IGF2) in sterlet (Acipenser ruthenus, Linnaeus, 1758)
Abstract
The application of molecular genetic technologies in livestock breeding makes it possible to increase the efficiency of artificial selection aimed at improving economically important traits. Insulin-like growth factor 2 (IGF2) is a polypeptide hormone that has a similar molecular structure to proinsulin and plays an important role in vertebrate growth and development. The effect of single nucleotide polymorphisms of the IGF2 gene on their size-weight characteristics has been demonstrated in different fish species. This article presents a study of polymorphisms in the coding part of paralogic insulin-like growth factor 2 (IGF2) genes in sterlet (Acipenser ruthenus). The aim of the research was to identify single nucleotide polymorphisms (SNPs) that could potentially influence fish growth and development. Based on the analysis of sterlet cDNA, the sequences of two paralogues of the IGF2 gene located on chromosomes 27 and 28 were obtained. After alignment, two SNPs were identified in the second exon of the IGF2 gene on chromosome 27: a thymine to cytosine substitution at position 348 (348 T > C) and a cytosine to thymine substitution at position 372 (372 C > T). At the same time, no substitutions were found in the paralog of the gene located on the 28th chromosome, which indicates that the structure of this copy is conservative. The use of marker-assisted selection based on SNPs will not only increase the productivity and sustainability of aquaculture populations, but also preserve the genetic diversity of valuable commercial fish species.
1. Введение
Изучение генетического разнообразия популяций ценных видов рыб, таких как стерлядь (Acipenser ruthenus), приобретает особую значимость в контексте сохранения биоразнообразия и оптимизации аквакультуры. Стерлядь, являясь представителем осетровых, имеет высокую экологическую и экономическую ценность, однако её природные популяции подвержены угрозам из-за антропогенного воздействия и изменения условий обитания . Поэтому искусственное разведение стало ключевым инструментом для сохранения этого вида и удовлетворения рыночного спроса на товарную продукцию . В аквакультуре активно используются две формы стерляди: традиционная одомашненная линия, адаптированная к условиям выращивания в неволе, и селекционная форма Стер-1, выведенная методом внутрипородной селекции, отличающаяся повышенной жизнестойкостью и устойчивостью к заболеваниям. Эти линии демонстрируют различия в скорости роста, метаболической эффективности и адаптации к стрессовым факторам, что делает их ценными моделями для изучения генетических основ хозяйственно-значимых признаков .
Для повышения эффективности отрасли аквакультуры необходимо внедрять результаты научных разработок, в том числе с использованием возможностей молекулярной генетики. Зарубежный опыт показывает, что в программах разведения рыбы в странах с развитой аквакультурой (Китай, Корея, Норвегия, Индия, Индонезия, Чили) для выявления полиморфизма генов, участвующих в формировании признаков продуктивности, применяются ДНК-технологии. Применение методов и подходов, основанных на анализе наследственной информации на уровне генов или групп сцепления генов даст возможность исследовать генофонд ремонтно-маточных стад производителей по уровню полиморфизмов генов-кандидатов, влияющих на проявление хозяйственно-полезных признаков и проводить более точный и эффективный отбор .
Первым шагом в разработке программ маркерной селекции является идентификация однонуклеотидных полиморфизмов в перспективных генах-кандидатах, и разработка тест-систем для определения генотипов. Затем проверяется корреляция между специфическими аллелями и фенотипическим проявлением признака. Обнаруженные взаимосвязи свидетельствуют о влиянии гена на генетический контроль признака , . Подобные исследования уже были проведены на стерляди, установлено, что несинонимичная мутация в позиции 400 С > А приводит к замене аминокислоты пролина на гистидин и, как следствие, к изменению пространственной структуры белка. Ассоциативный анализ выявил наличие достоверного влияния генотипа по SNP 400 С > А на размеры и массу стерляди .
Инсулиноподобный фактор роста 2 (IGF2) является ключевым элементом системы регуляции роста и дифференцировки клеток у позвоночных, включая рыб. Он участвует в процессах эмбрионального развития, роста тканей, онтогенетической дифференцировке гонад и адаптации к внешним условиям среды , . У млекопитающих IGF2 является эволюционно консервативным пептидным гормоном, структурно гомологичным проинсулину . Позвоночные содержат один ген инсулиноподобного фактора роста 2 в геноме, но у некоторых видов рыб ученые обнаружили присутствие двух и более паралогов гена IGF2. Например, два гена IGF2 (IGF2a и IGF2b) были обнаружены у данио-рерио и белого амура , . Существование более чем одного паралогичного гена является следствием нескольких раундов дупликации генома, произошедшей у рыб , . Экспрессия инсулиноподобного фактора роста 2 контролируется сложными эндокринными и паракринными механизмами в которых задействованы гормон роста (GH) и гонадолиберин (GnRH). У рыб ген IGF2 включает четыре экзона и три интрона . У млекопитающих ген функционирует преимущественно в эмбриональный период, в то время как у рыб его активность сохраняется и во взрослом возрасте, что свидетельствует о возможных отличиях в механизмах регуляции между различными группами позвоночных .
Несмотря на высокую консервативность генетической структуры инсулиноподобного фактора роста среди позвоночных, в его кодирующей области могут встречаться как синонимичные, так и несинoнимичные мутации, способные изменить аминокислотный состав белка и, соответственно, его биологическую активность. Исследование таких полиморфизмов позволяет глубже понять механизмы, регулирующие рост и развитие рыб, а также выявить потенциальные маркеры для использования в селекционных программах объектов аквакультуры . Полиморфизмы в интронных регионах, хотя и не приводят к прямой модификации последовательности белка, могут влиять на альтернативный сплайсинг, эффективность трансляции и стабильность мРНК , .
Цель работы — идентификация и описание однонуклеотидных полиморфизмов в мРНК паралогичных кодирующей части функциональных копий гена IGF2 у стерляди выявить структурные вариации в гене, которые могут приводить к изменению аминокислотной последовательности и потенциально влиять на процессы роста и развития стерляди. Полученные данные могут быть полезны как для фундаментального изучения генетики IGF2 у рыб, так и для прикладных задач в области селекции и аквакультуры.
2. Методы и принципы исследования
Исследования проводили на популяциях стерляди, выращиваемой в установке замкнутого водоснабжения (УЗВ) (ФГБНУ ФИЦ ВИЖ им. академика Л.К. Эрнста, 2024 год). В УЗВ периодически контролировали температуру воды (20–22 °C), содержание аммония (NH4) (< 0,5 мг/л), нитритов (NO2) (0,1 мг/л), нитратов (NO3) (20 мг/л), рН (7,2–7,6), содержание аммиака (NH3) (< 0,01мг/л) и кислорода (О2) (9,8-11,0 мг/л), чтобы поддерживать качество воды оптимальным для разведения рыбы. Для получения биоматериала проводили забой стерляди (n=16). Тотальную РНК выделяли из фрагментов печени с помощью комплекта реагентов РНК-ЭКСТРАН (НПО «Синтол», Россия) согласно инструкции производителя. Синтез первой цепи ДНК на РНК-матрице проводили с использованием набора реагентов для обратной транскрипции (НПО «Синтол», Россия) по методике производителя. Концентрацию РНК оценивали cпектрофотометрически (NanoDrop 8000, «Thermo Fisher Scientific, Inc.», США). ПЦР выполняли на амплификаторе Thermal Cycler SimpliAmp («Thermo Fisher Scientific, Inc.», США) в следующем режиме: 5 мин при 95 °С (первичная денатурация); 35 с при 95 °С (денатурация), 35 с при 60 °С (отжиг праймеров на ДНК-матрице), 40 с при 72 °С (элонгацию цепей) (40 циклов); 7 мин при 72 °С (финальная элонгация). Состав реакционной смеси на 20 мкл был следующим: 2 мкл 10½ Taq Turbo-буфера (ЗАО «Евроген», Россия), 2 мкл 2 мМ раствора dNTPs, 1 мкл 10 мМ смеси праймеров, 1 ед. Smart Таq-полимеразы (ЗАО «Диалат Лтд.», Россия). Добавляли ~ 50-100 нг исследуемой кДНК, до конечного объема доводили деионизированной водой. В реакции использовали следующие праймеры (см. таблица 1.):
Таблица 1 - Последовательность праймеров для гена IGF2 стерляди
Ген | Хромосома | Нуклеотидная последовательность | Температура отжига, ˚C | Длина ампликона, п.н |
IGF2 | 27 | F: GCAACGTTAACCTCAATACCAAA | 59 | 694 |
R: CGTAGTTCT CCGTCAAAGGTT | 60 | |||
IGF2 | 28 | F: ACAACGTTATCCTCAGTACCAAA | 59 | 694 |
R: TGTAATTCTCCGTCAAAGGTTTAA | 60 |
Детекцию результатов ПЦР осуществляли в 1–2% агарозном геле с использованием колориметрической системы гель-документирования Uvitec FireReader V10 imaging System («Cleaver Scientific», Великобритания). Качественные образцы использовали для дальнейшей очистки. Эталонные последовательности были отобраны в базе данных GenBank (NCBI). Праймеры подбирали с помощью онлайн программы Олигокалькулятор (OligoCalk) (http://biotools.nubic.northwestern.edu/OligoCalc.html). Реакционные смеси очищали с использованием набора Cleanup Mini (ЗАО «Евроген», Россия). Последовательности ДНК определяли секвенированием по Сэнгеру на генетическом анализаторе Нанофор 05 (НПО «Синтол», Россия) с использованием набора GenSeq (НПО «Синтол», Россия) и реагентов для очистки сиквенсных смесей SQ-Magno-Clean (ООО «НПФ «ЭПИТОП», Россия) согласно инструкциям производителя. Выравнивание нуклеотидных последовательностей проводили с использованием программного обеспечения BioEdit v7.7.1.0 («Tom Hall», США).
3. Основные результаты
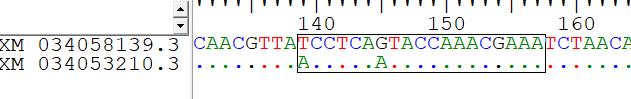
Рисунок 1 - Фрагмент выравнивания эталонных последовательностей гена IGF2 стерляди
Примечание: Acipenser ruthenus, Linnaeus, 1758): верхняя последовательность – 28-я хромосома, нижняя – 27-я хромосома
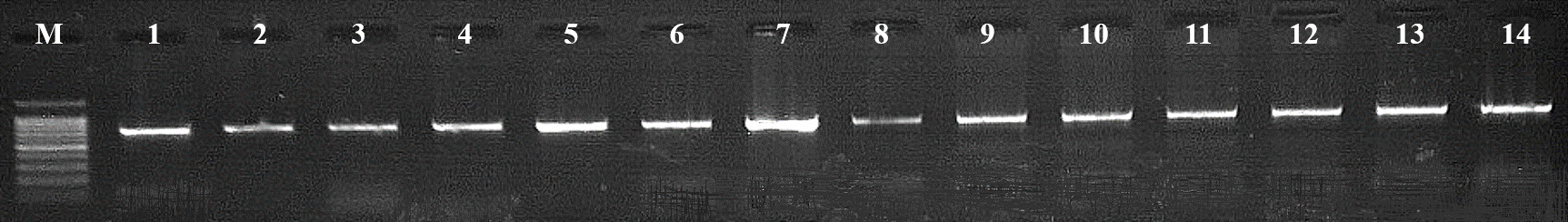
Рисунок 2 - Электрофореграмма результатов ПЦР-амплификации гена IGF2 стерляди (Acipenser ruthenus, Linnaeus, 1758):
М – маркер молекулярных масс (DNA Ladder 100+ bp, ЗАО «Евроген»; 1-7 – ПЦР-продукт гена IGF2, расположенного на 27-й хромосоме (694 п.н.); 8-14 – ПЦР-продукт гена IGF2, расположенного на 28-й хромосоме (694 п.н.)
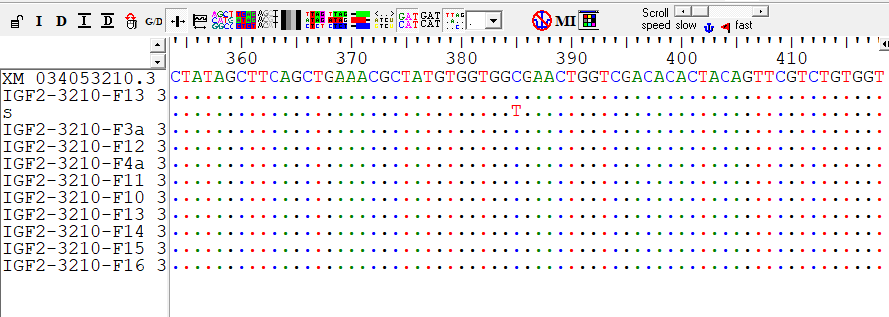
Рисунок 3 - Фрагмент множественного выравнивания гена IGF2 стерляди
Примечание: Acipenser ruthenus, Linnaeus, 1758
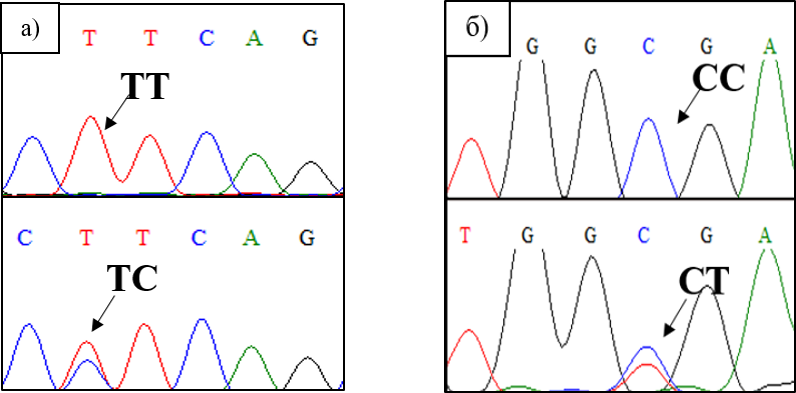
Рисунок 4 - Фрагменты хроматограмм последовательностей гена IGF2 стерляди (Acipenser ruthenus, Linnaeus, 1758), расположенного на 27-й хромосоме:
а – SNP 348 Т > С; б – SNP 372 С > Т
4. Обсуждение
Во многих исследованиях установлено, что однонуклеотидные полиморфизмы связаны с особенностями роста у костистых рыб и успешно применяются в маркерной селекции , , , . Например, у нильской тилапии (Oreochromis niloticus) SNP, расположенный в 3 интроне гена IGF2, связан с массой тела . Аналогичные результаты были получены у европейского морского окуня (Dicentrarchus labrax) и пятнистого морского окуня (Lateolabrax maculatus) , . Вышеобозначенные работы показали возможность использования инсулиноподобного фактора роста 2 в качестве гена-кандидата для отбора по признакам роста, несмотря на то, что замены, в основном, располагались в не кодирующих регионах. Поэтому считаем, что выявленные в нашем исследовании SNPs можно использовать для проведения ассоциативных исследований с показателями роста и развития стерляди, разводимой в условиях аквакультуры. Для этого необходимо разработать тест-системы и провести генотипирование исследуемой популяции, затем с использованием данных бонитировки провести анализ влияния генотипа по SNP 348 Т > С и SNP 372 С > Т на размерно-весовые показатели стерляди.
5. Заключение
В результате секвенирования последовательностей кДНК инсулиноподобного фактора роста 2 у стерляди идентифицировано два однонуклеотидных полиморфизма (SNP 348 Т > С; SNP 372 С > Т), расположенных во 2 экзоне гена (хромосома 27). Замены являются синонимичными и не приводят к изменению аминокислотного состава белка, однако, считаем для дальнейшего изучения влияния полиморфизмов гена IGF2 необходимо смоделировать тест-системы и провести генотипирование рыбы для исследования влияния выявленных SNP на показатели роста и развития стерляди. В целом, работа подчеркивает важность исследования полиморфизмов ключевых генов-кандидатов, таких как IGF2, связанных с экономически важными признаками, для изучения биоразнообразия и разработки стратегий устойчивого управления генетическими ресурсами аквакультурной стерляди.
