Mорфометрические и биохимические показатели Portulaca oleracea L. в условиях засоления при культивировании in vitro и с применением гидропоники
Mорфометрические и биохимические показатели Portulaca oleracea L. в условиях засоления при культивировании in vitro и с применением гидропоники
Аннотация
Настоящее исследование посвящено изучению влияния засоления на морфометрические показатели и синтез вторичных метаболитов Portulaca oleraceae при культивировании in vitro и с применением гидропоники. Условия засоления создавали добавлением в питательные среды NaCl в концентрациях 25, 50, 100, 200, 300, 400 и 500 мМ. Влияние на морфометрические показатели оценивали по изменениям высоты побегов, сырой и сухой биомассы побегов, а также сырой и сухой биомассы листьев. Определение общего содержания соединений фенольной природы и антиоксидантной активности проводили спектрофотометрически. Установлено, что при культивировании in vitro по мере увеличения концентрации NaCl в среде (до 25–100 мМ) высота побега возрастала. Прирост сырой биомассы наблюдался для растений, культивируемых in vitro и выращиваемых на гидропонике, с увеличением содержания хлорида натрия до 200 и 100 мМ соответственно. Наибольшее содержание суммы фенольных соединений и гидроксикоричных кислот для P. oleracea, культивируемого гидропонным способом, выявлено при 25–200 мМ NaCl. Растения in vitro, выращенные на среде с добавлением 50-200 и 200 мМ NaCl, так же имели наибольшее содержание суммы фенольных соединений и гидроксикоричных кислот соответственно. При культивировании in vitro наибольший уровень флавоноидов в P. oleracea отмечался на концентрации 300 мМ NaCl. Выявлено стимулирующее действие средних и высоких концентраций NaCl (100-300 мМ) на антиоксидантный потенциал P. oleracea при различных способах культивирования. По результатам изучения морфометрических показателей и биологически активных соединений рекомендованы следующие оптимальные концентрации NaCl: для гидропонного выращивания — 100 мМ, для культивирования in vitro — 200 мМ.
1. Введение
Засоление почв негативно влияет на урожайность культур, создавая сложности в обеспечении продовольствием растущего населения. Расширение объема и ассортимента сельскохозяйственных культур за счет растений-галофитов позволит сократить ущерб, вызванный повышением уровня солей в почвах. Галофиты способны выживать и завершать свои жизненные циклы в средах с высокой соленостью, не испытывая серьезных негативных последствий для своего роста или развития. Устойчивость этой группы растений к солевому стрессу обусловлена различными адаптационными механизмами, в том числе, включающими в себя интенсификацию синтеза вторичных метаболитов фенольной природы и антиоксидантов. Таким образом, внедрение галофитов в практику растениеводства позволит также повысить уровень потребления биологически активных веществ и обеспечит более сбалансированный рацион питания населения.
Одним из перспективных растений галофитов является портулак огородный (Portulaca oleracea L.) — однолетнее растение, широко распространенное в тропических и субтропических районах мира, где употребляется в пищу , . P. oleracea является высокопитательной зеленной культурой, богатой витаминами (особенно A и C), минералами (калий, магний, кальций), антиоксидантами и незаменимыми жирными кислотами омега-3 и омега-6 , . В листьях и стеблях P. oleracea отмечается высокое содержание таких вторичных метаболитов, как флавоноиды (апигенин, кемпферол, лютеолин, кверцетин), каротиноиды, стерины, фенольные кислоты (кофейная кислота, п — кумаровая кислота и феруловая кислота) , , .
В последнее время большое внимание привлекают технологии беспочвенного выращивания сельскохозяйственных культур, позволяющие обеспечивать продовольственные потребности, особенно в регионах с плохим качеством почвы или ограниченными пахотными землями. Одной из таких технологий является гидропонное выращивание , . Обогащенные питательными веществами растворы помогают добиться максимальной производительности на единицу площади, а такой ценный в наше время ресурс, как вода, используется с высокой эффективностью . Наряду с различными вариантами гидропонного выращивания растений, все более актуальными становятся разработка и оптимизация технологий культивирования in vitro, которые обеспечивают получение асептического материала, исключая риск заражения патогенами, позволяют строго контролировать условия и четко задавать параметры роста , . При культивировании растений все необходимые вещества содержатся в питательной среде, что и позволяет обеспечить оптимальные условия для их роста и развития, а также адаптировать состав среды в зависимости от специфических потребностей различных видов растений . Кроме того, изменяя состав среды, возможно контролировать и модулировать накопление в растениях различных биологически активных соединений и повышать, таким образом, нутрицевтическую ценность продуктов питания растительного происхождения.
Ранее было показано, что выращивание P. oleracea с применением гидропоники в условиях засоления приводит к повышению уровня фенольных соединений , . Однако, информации о влиянии солевого стресса на рост и другие морфометрические показатели портулака недостаточно для полного понимания его адаптационных механизмов. При этом, отметим, что информация о культивировании портулака in vitro полностью отсутствует. Таким образом, влияние засоления на синтез вторичных метаболитов как в культуре клеток и тканей in vitro, так и при гидропонном выращивании остается важным и актуальным аспектом в изучении P. oleracea. В связи с этим целью настоящего исследования явилось изучение влияния различных концентраций хлорида натрия (25–500 мМ NaCl) на морфометрические (высота побега, сырая и сухая биомасса побегов и листьев) и биолого-химические показатели (суммарное содержание фенольных соединений, флавоноидов, гидроксикоричных кислот и антиоксидантная активность) P. oleracea, культивируемого в условиях гидропоники и in vitro.
2. Методы и принципы исследования
В качестве объекта исследования использовали портулак огородный (Portulaca oleracea L.) сорта Парадокс. При выращивании гидропонным методом, семена портулака высаживали в перлит и поливали ½ питательного раствора Хогланда . Спустя две недели, на стадии четырех настоящих листьев, портулак пересаживали в вегетационный сосуд (по 4 растения) объемом 2 л с питательным раствором. Влияние засоления изучалось с использованием жидкой питательной среды Хогланда с различным содержанием хлорида натрия: 0, 25, 50, 100, 200, 300, 400 и 500 мМ. Аэрация среды осуществлялась компрессором (Hailea ACO 388d). Во время выращивания в теплице поддерживались следующие условия: влажность 70%; день — 22 °С, 16 ч; ночь — 18 °С, 8 ч; фотосинтетически активное излучение 320 мкмоль (м–2с−1). Экспериментальная выборка состояла из 18 вегетационных сосудов (n=3) .
При выращивании in vitro семена портулака обрабатывали H2SO4 (конц) и стерилизовали раствором гипохлорита натрия (содержащего 1–2% активного хлора). Герминация проводилась 14 суток в чашках Петри со средой Мурасиге-Скуга (MS) (pH 5,8), дополненной сахарозой (8 г/л) и агаром (7 г/л) без регуляторов роста.
Для проведения эксперимента использовали проростки длиной 5-10 мм, которые были помещены на 100 мл среды MS (pH 5,8) без регуляторов роста, содержащую 30 г/л сахарозы и 7 г/л агара. NaCl был добавлен в среду в концентрациях 0, 25, 50, 100, 200, 300, 400 и 500 мМ. Культивирование осуществляли в емкостях для культуры тканей Phytohealth (SPL Lifesciences, Республика Корея) по 7 растений в каждом при 25 ± 2 °C с использованием 16-часового фотопериода (белые светодиодные лампы; плотность потока фотосинтетических фотонов 160 мкмоль м−2 с−1). Экспериментальная выборка состояла из 24 культуральных емкостей (n=3).
Растительный материал собирали через 40 дней культивирования in vitro и в условиях гидропоники. Проводили измерения ростовых характеристик: высоты побегов, длины корней, сырой и сухой биомассы побегов, листьев и корней. Растительный материал из каждого сосуда для заданной концентрации NaCl анализировали отдельно (n = 3 для гидропоники и in vitro). Для определения сухой биомассы растительный материал лиофилизировали в течение суток до постоянной массы (Bios BK-FD12S (Китай)).
Сухой растительный материал измельчали до размера частиц менее 0,5 мм. Экстракцию вторичных метаболитов проводили 70% раствором этанола при комнатной температуре в течение 24 часов на орбитальном шейкере (OS-20, Biosan, Латвия). Затем экстракт центрифугировали (6000g, 15 мин); супернатант использовали для дальнейших анализов.
Для определения содержания соединений фенольной природы и антиоксидантной активности использовали мультимодальный ридер (CLARIOstar, BMG Labtech, Ортенберг, Германия). Измерения оптической плотности проводили с помощью плоскодонного 96-луночного планшета.
Количественное содержание фенольных соединений определяли спектрофотометрическим методом с помощью реагента Фолина-Чокалтеу ; общее содержание гидроксикоричных кислот — с реактивом Арно ; содержание флавоноидов — по реакции образования окрашенного комплекса с хлоридом алюминия в присутствии ацетата натрия . Антиоксидантную активность экстракта P. oleracea измеряли по способности захватывать радикалы 2,2-дифенил-1-пикрилгидразил (DPPH) и 2,2′-азино-бис (3-этилбензтиазолино-6-сульфоновой кислоты (ABTS) и восстанавливать Fe (III) в комплексе с 2,4,6-трипиридил-s-триазином (FRAP) в соответствии с .
Статистическую обработку экспериментальных данных проводили с использованием IBM SPSS Statistics 25. Для проверки статистических гипотез и оценки достоверности различий использовали однофакторный дисперсионный анализ (ANOVA) с последующим тестом Тьюки HSD (p ≤ 0,05). Статистические результаты представлены в виде среднего значения ± стандартное отклонение. Разными буквенными индексами на рисунках обозначены статистически значимые различия. На основе нормализованных средних значений анализируемых переменных проводили кластеризацию и построение тепловой карты с использованием программы 2019b (OriginLab Corporation, Нортгемптон, Массачусетс, США). В качестве меры сходства использовалось Евклидово расстояние.
3. Результаты и обсуждение
Для оценки влияния засоления (25–500 мМ NaCl) на морфометрические параметры портулака, культивируемого в условиях гидропоники и in vitro, измеряли высоту побегов, сырую и сухую биомассу побегов, а также сырую и сухую биомассу листьев.
Высота побегов P. oleracea, выращенного гидропонным методом на среде Хогланда с разной концентрацией хлорида натрия, уменьшалась по мере увеличения солености от 0 до 300 мМ NaCl. Максимальная высота побега была характерна для растений из контрольной группы и составила 117,2 ± 5,1 мм. При концентрации 100 мМ NaCl наблюдалось незначительное увеличение данного показателя (103,1 ± 3,1 мм) по сравнению с более низкими концентрациями NaCl (25 и 50 мМ); при концентрациях 200–300 мМ NaCl выявлены явные признаки угнетения роста растений, а на концентрациях 400-500 мМ растения погибли (Рисунок 1а).
В результате эксперимента по оценке засоления растений, культивируемых in vitro на среде MS, были получены следующие результаты: по мере увеличения концентрации соли от 0 до 100 мМ высота побега увеличивалась и достигала максимума при 100 мМ (19,6±2,04 мм). Далее при повышении уровня солености до 300-500 мМ NaCl высота побега начинала уменьшаться и на концентрации 500 мМ NaCl наблюдался минимум — 7,00±3,56 мм (Рисунок 1б).
В результате анализа ANOVA с критерием Тьюки было установлено наличие статистически значимых различий в сырой биомассе побегов P. oleracea, культивируемых в условиях гидропоники на среде с разной концентрацией NaCl (ANOVA, F = 30,17, df1 = 5, df2 = 12, p ≤ 0,001). Сырая биомасса побега увеличивалась по мере увеличения солености от 0 до 100 мМ NaCl. Наибольшая сырая биомасса побега (7,67 ± 1,46 г) наблюдалась при концентрации 100 мМ NaCl (ANOVA, F = 30,17, df1 = 5, df2 = 12, p ≤ 0,001) (Рисунок 1в). При последующем увеличении солености до 200-300 мМ NaCl сырая биомасса побегов резко уменьшалась и достигала минимума – 0,69 ± 0,05 г.
Для растений P. oleracea, культивируемых in vitro, также выявлены статистически значимые различия в значении сырой биомассы побегов (ANOVA, F = 164,9, df1 = 7, df2 = 15, p ≤ 0,001). Как видно из представленных на рисунке 1г данных, сырая биомасса побега увеличивалась по мере увеличения солености от 0 до 200 мМ NaCl. Наибольшая биомасса (0,53 ± 0,024 г) наблюдалась при концентрации 200 мМ NaCl (ANOVA, F = 5,45, df1 = 7, df2 = 92, p ≤ 0,001). Далее при увеличении солености до 300-500 мМ NaCl сырая биомасса побега начинала уменьшаться. На концентрации 500 мМ NaCl значение было минимальным – 0,063 ± 0,008 г.
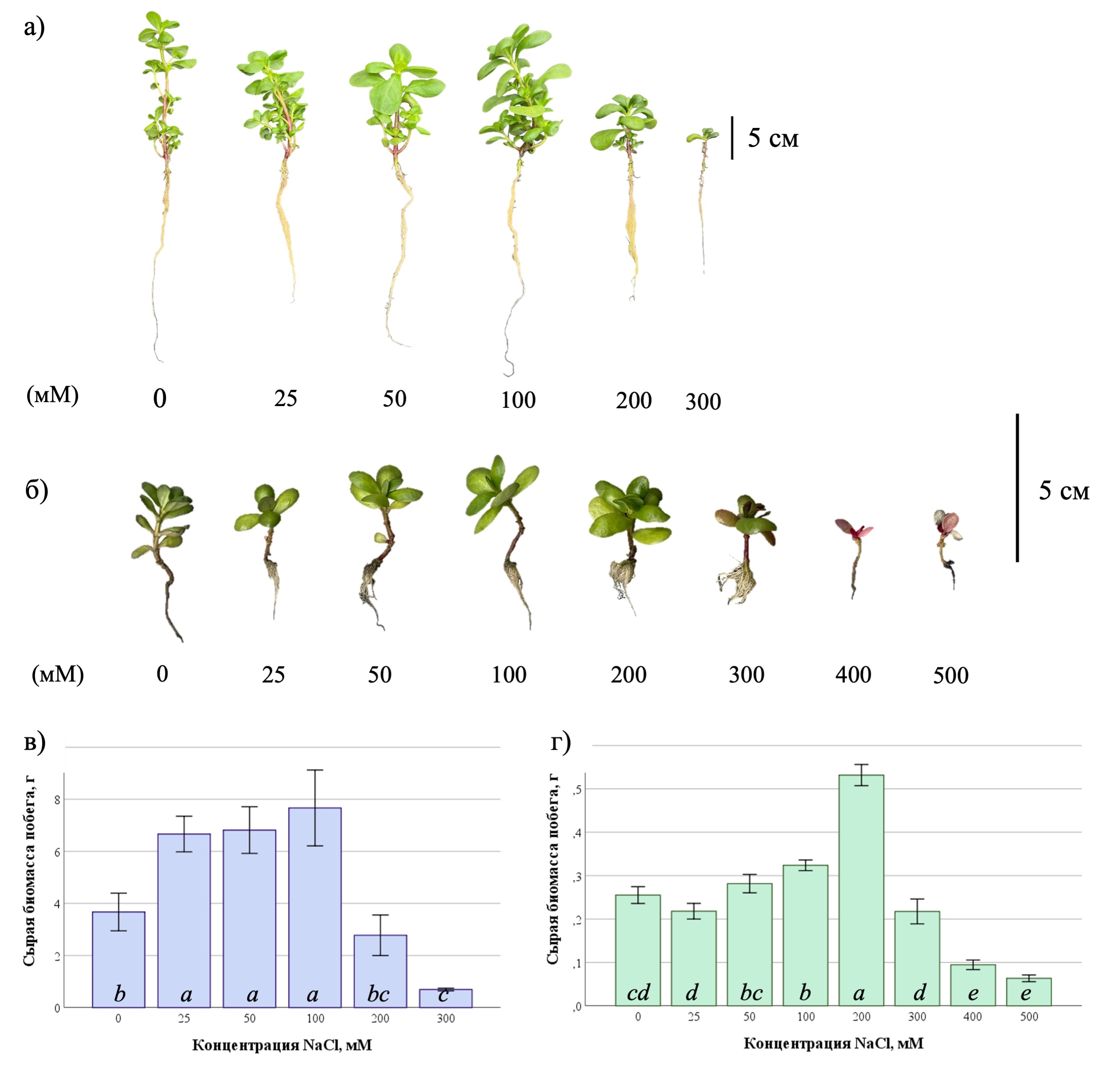
Рисунок 1 - Влияние различных уровней засоления на морфометрические параметры растения P. oleracea:
а – фотография экспериментальных растений, выращенных гидропонным методом; б – фотография экспериментальных растений, культивируемых in vitro; в – показатели средней сырой биомассы побегов растений, произрастающих в условиях гидропоники; г – показатели средней сырой биомассы побегов растений, культивируемых in vitro
Для оценки влияния различных уровней солевого стресса (25–500 мМ NaCl) на содержание фенольных соединений P. oleracea, культивируемого в условиях гидропоники и in vitro, оценивали суммарное содержание фенольных соединений, суммарное содержание флавоноидов и суммарное содержание гидроксикоричных кислот (Рисунок 2).
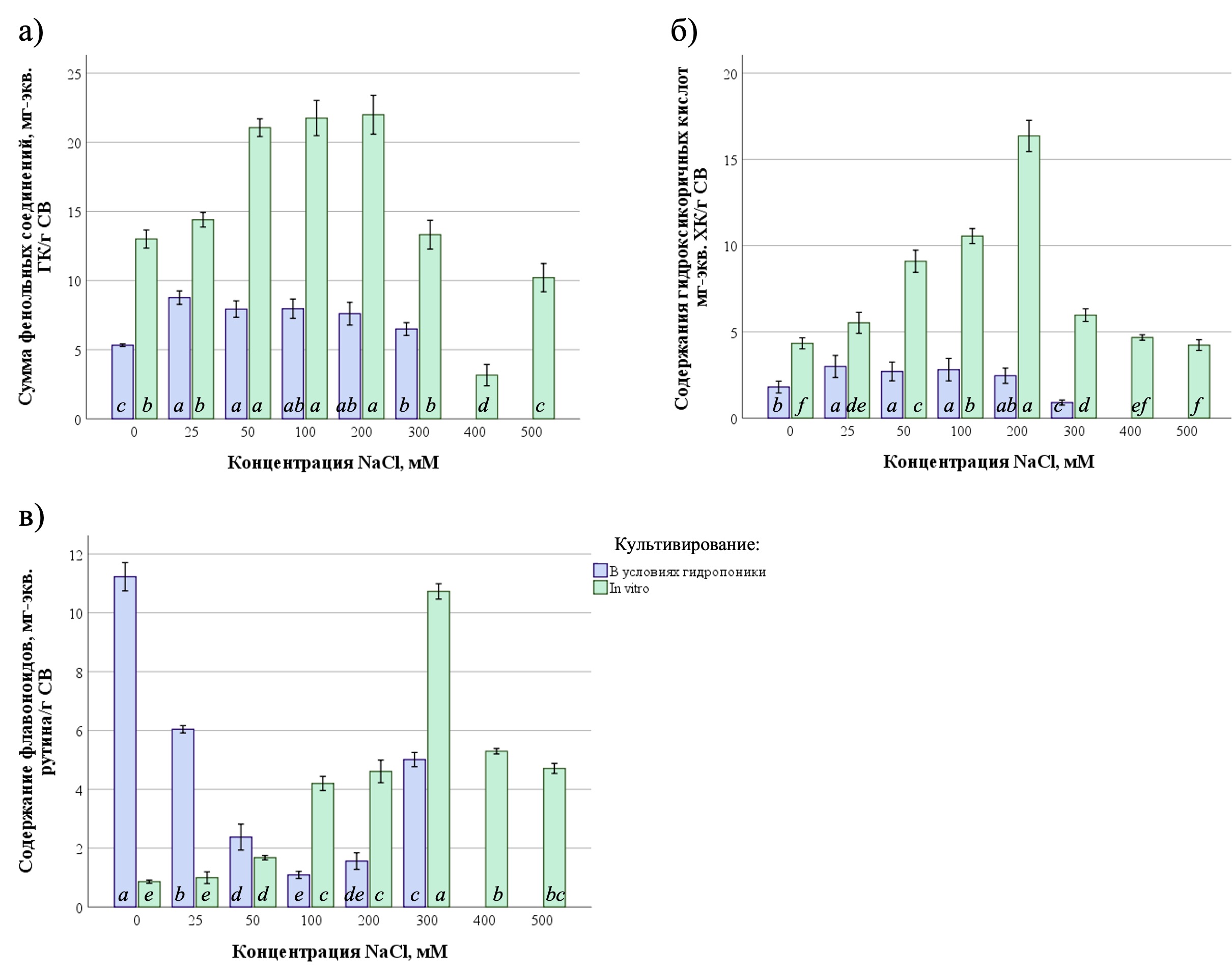
Рисунок 2 - Влияние различных уровней засоления на содержание соединений фенольной природы в растениях P. oleracea, культивируемых на гидропонике и in vitro:
а – сумма фенольных соединений; б – содержание гидроксикоричных кислот; в – содержание флавоноидов; ГК – галловая кислота, ХК – хлорогеновая кислота; СВ – сухой вес
Исследование влияния различных уровней засоления на содержание гидроксикоричных кислот показало, что в условиях гидропоники наибольшее содержание данных вторичных метаболитов наблюдалось при концентрациях 25-100 мМ NaCl (ANOVA, F = 23,1, df1 = 5, df2 = 48, p ≤ 0,001) и составляло 2,7–2,9 мг/г. При культивировании in vitro более высокие показатели по сравнению с контролем получены при добавлении в среду NaCl в концентрациях 25–300 мМ (ANOVA, F = 443,03, df1 = 7, df2 = 43, p ≤ 0,001). Максимальное содержание гидроксикоричных кислот установлено в растениях, культивируемых in vitro при 200 мМ NaCl (16,4 ± 0,9 мг/г).
Также выявлены статистически значимые различия в суммарном содержании флавоноидов P. oleracea, культивируемых в условиях гидропоники (ANOVA, F = 443, df1 = 5, df2 = 12, p ≤ 0,001) и in vitro (ANOVA, F = 654,3, df1 = 7, df2 = 23, p ≤ 0,001). Стоит отметить, что в отличии от других исследованных групп вторичных метаболитов, содержание флавоноидов в P. oleracea, культивируемых в условиях гидропоники, при добавлении в среду NaCl было в 1,9–10,3 раз ниже по сравнению с контрольными растениями. При культивировании in vitro, напротив, сохранялась общая тенденция по стимулирующему действию засоления на содержание флавоноидов. Наибольшее значение было установлено при концентрации 300 мМ NaCl (10,7±0,26 мг/г).
Известно, что увеличение содержания фенольных соединений в ответ на абиотические стрессы является общей стратегией защиты у разных видов растений. Считается, что галофиты, способные произрастать в условиях повышенного засоления, накапливают фенолы и флавоноиды в более высоких концентрациях, чем другие растения, растущие в районах с нормальной соленостью и водными условиями , , . Полученные в нашем исследовании результаты по увеличению содержания отдельных групп вторичных метаболитов фенольной природы в P. oleracea под действием NaCl согласуются с имеющимися в литературе данными. В частности, ранее было показано, что суммарное содержание фенольных соединений и флавоноидов в P. oleracea subsp. oleracea в условиях солевого стресса (100-400 мМ NaCl) было достоверно выше по сравнению с контрольными растениями .
Для оценки влияния различных уровней солевого стресса (25–500 мМ NaCl) на антиоксидантную активностьP. oleracea, культивируемого в условиях гидропоники и in vitro, оценивали антиоксидантную активность методами DPPH, FRAP, ABTS (Рисунок 3)
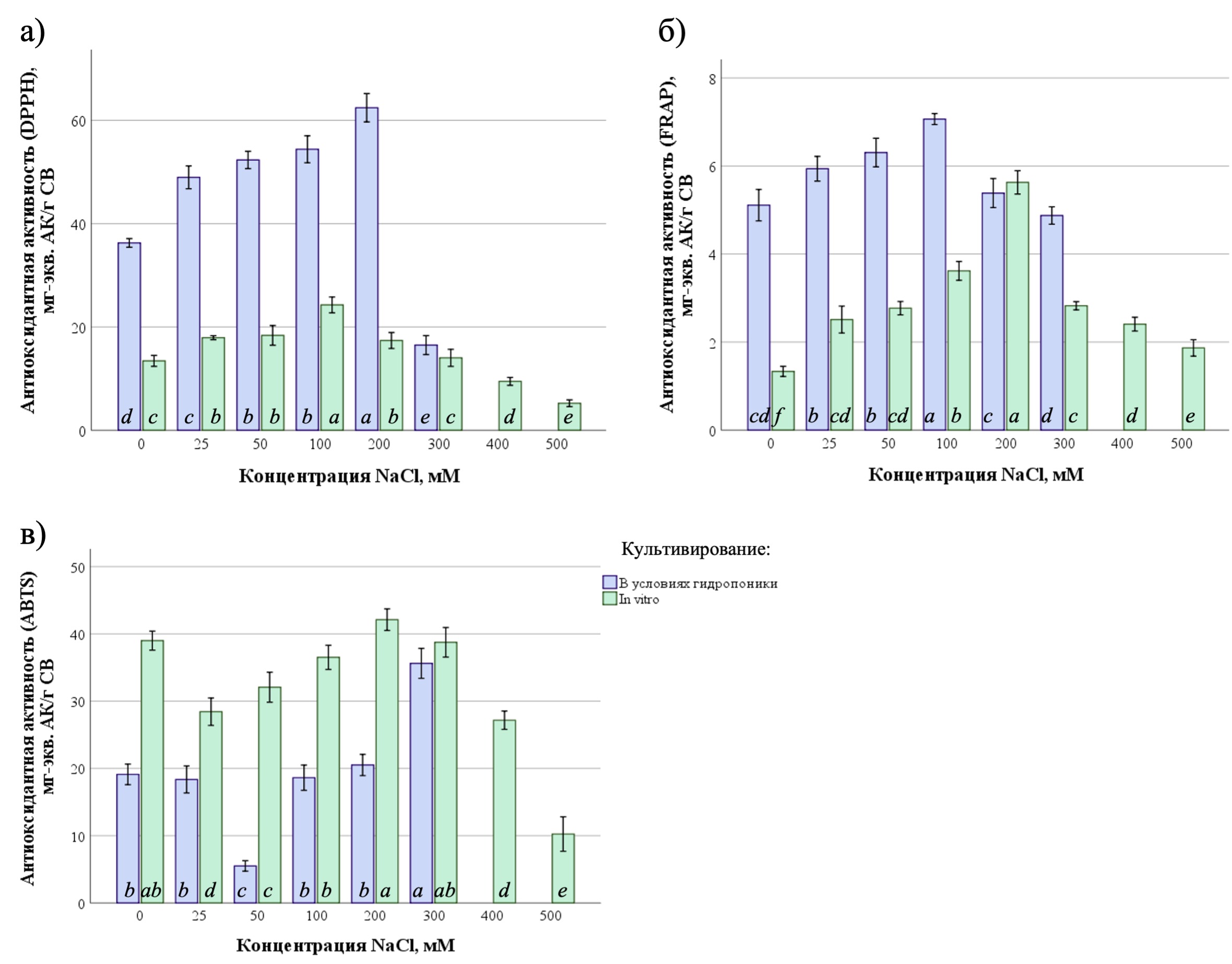
Рисунок 3 - Антиоксидантная активность экстрактов растений P. oleracea, произрастающих в условиях гидропоники и in vitro на питательных средах с разной концентрацией хлорида натрия, определённая методами:
а – DPPH (по способности связывать радикал 2,2-дифенил-1-пикрилгидразила); б – FRAP (по способности восстанавливать Fe (III) в комплексе с 2,4,6-трипиридил-s-триазином); в – ABTS (по способности связывать радикал 2,2′-азино-бис (3-этилбензтиазолино-6-сульфоновой кислоты); АК – аскорбиновая кислота; СВ – сухой вес
В результате проведенных исследований было установлено наличие статистически значимых различий антиоксидантной активности по методу FRAP для растений P. oleracea, культивируемых на средах с разной концентрацией NaCl в условиях гидропоники (ANOVA, F= 76,8, df1 = 5, df2 = 48, p ≤ 0,001) и in vitro (ANOVA, F = 284,3, df1 = 7, df2 = 49, p ≤ 0,001). Антиоксидантная активность при гидропонном выращивании увеличивалась по мере увеличения солености от 25 до 100 мМ NaCl. Наибольшее значение (7,07 ± 0,13 мг-экв. АК/г) наблюдалось при концентрации 100 мМ NaCl (Рисунок 3б). При культивировании in vitro более высоким значением антиоксидантной активности характеризовались растения, культивируемые на средах с добавлением NaCl (25-500 мМ). Наибольшая антиоксидантная активность (5,63 ± 0,26 мг-экв. АК/г) выявлена при 200 мМ NaCl.
Статистически значимые различия в антиоксидантной активности растений P. oleracea, культивируемых в условиях гидропоники (ANOVA, F = 275,9, df1 = 5, df2 = 48, p ≤ 0,001) и in vitro (ANOVA, F = 205,9, df1 = 7, df2 = 49, p ≤ 0,001) установлены также и при использовании метода ABTS. Однако, стоит отметить, что в этом случае достоверное увеличение антиоксидантной активности по сравнению с контролем выявлено только при внесении в среду 300 мМ NaCl и только в условиях гидропонного выращивания.
Считается, что солевой стресс приводит к повышению уровня активных форм кислорода и развитию окислительного стресса . В качестве ответной реакции на это в растениях усиливается биосинтез соединений с антиоксидантными свойствами, и соответственно возрастает антиоксидантная активность. Так, было показано, что в условиях засоления наблюдается повышение антиоксидантный активности нативных растений Portulaca oleracea L., собранных в разных регионах Западной Малайзии . Вместе с тем рядом авторов отмечается, что высокие уровни солевого стресса, как правило более 200–300 мМ, напротив, приводят к снижению антиоксидантный активности, что указывает на возможное ослабление защитных механизмов растения под воздействием высоких концентраций соли . При этом для галофита Ledum decumbens, при его обработке различными концентрациями NaCl (50, 100 и 200 мМ), достоверных изменений антиоксидантной активности по сравнению с контрольными растениями выявлено не было, что может свидетельствовать об устойчивости этого вида к солевому стрессу или о том, что его антиоксидантные механизмы не активируются в ответ на изменения в уровне соли . По результатам, полученным в ходе нашего исследования, выявлены оптимальные концентрации хлорида натрия (100-300 мМ), оказывающие наибольший стимулирующий эффект на антиоксидантную активность экстрактов P. oleracea, что не совсем согласуется с имеющимися в литературе данными. Следовательно, можно судить о том, что реакция антиоксидантный системы на солевой стресс сильно зависит от конкретного вида и сорта растения, а также от продолжительности воздействия стрессового фактора.
На основе нормализованных значений изученных параметров была построена тепловая карта с кластерным анализом (Рисунок 4). Дендрограмма, представленная на рисунке 4 (вверху), демонстрирует, что все изученные параметры можно разделить на два кластера. Первый кластер включает все изученные морфометрические характеристики и антиоксидантную активность по методам DPPH и FRAP. Второй кластер включает общее содержание фенольных соединений, содержание гидроксикоричных кислот и флавоноидов, а также антиоксидантную активность по методу ABTS.
На дендрограмме слева показано, что P. oleracea можно разделить на два больших кластера (Рисунок 4). Первый из них состоит из растений, культивируемых in vitro, а также портулака, выращенного гидропонным методом при концентрации 300 мМ NaCl, а второй — из растений, культивируемых на гидропонике при засолении 0-200 мМ NaCl. Среди растений, выращенных на гидропонике, по результатам кластерного анализа можно выделить группу, которая включала растения, выращенные в диапазоне концентраций NaCl от 25 до 100 мМ. Для этих растений были характерны как более высокие значения морфометрических показателей, так и более интенсивное накопление биологически активных соединений.
Среди растений, культивируемых in vitro, на основе кластерного анализа можно выделить группу растений, выращенных на питательной среде с содержанием NaCl от 50 до 200 мМ. Растения этой группы также характеризовались лучшими ростовыми параметрами и более высоким содержанием вторичных метаболитов фенольной природы.
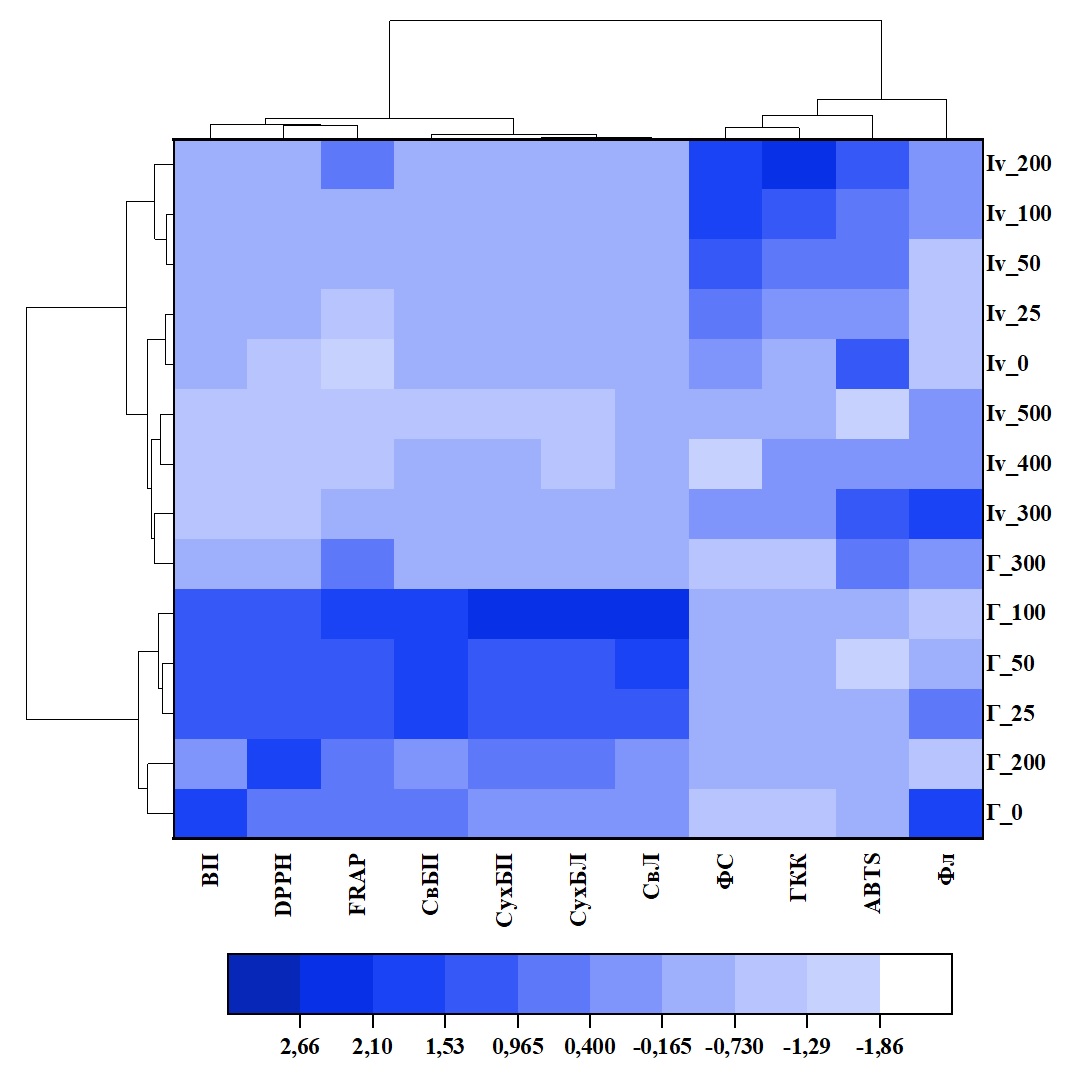
Рисунок 4 - Тепловая карта с кластерами для изучаемых переменных (вверху) и концентраций NaCl для растений, произрастающих на гидропонике и in vitro (слева):
ВП – высота побега; СвБП – сырая биомасса побегов; СвПЛ – сырая биомасса листьев; СухБП – сухая биомасса побегов; СухБЛ – сухая биомасса листьев; ФС – общее содержание фенолов; ГКК – общее содержание гидроксикоричных кислот; ФЛ – общее содержание флавоноидов; DPPH – антиоксидантная активность, определяемая с помощью анализа DPPH (2,2-дифенил-1-пикрилгидразил); ABTS – антиоксидантная активность, определяемая с помощью анализа ABTS (2,2'-азино-бис (3-этилбензотиазолин-6-сульфоновая кислота)); FRAP – антиоксидантная активность, измеренная по способности восстанавливать Fe (III) в комплексе с 2,4,6-трипиридил-s-триазином
4. Заключение
По результатам проведенного исследования было показано, что введение в стандартные питательные среды — Хогланда при гидропонном выращивании и Мурасиге-Скуга при культивировании in vitro — хлорида натрия в различных концентрациях позволяет улучшить как ростовые характеристики, так и питательную ценность P. oleracea за счет увеличения содержания в нем фенольных соединений и антиоксидантной активности. При гидропонном выращивании в качестве оптимальной может быть рекомендована концентрация хлорида натрия 100 мМ, при культивировании in vitro — 200 мМ. Стратегия увеличения содержания соединений фенольной группы и повышения антиоксидантной активности за счет введения в среду хлорида натрия свидетельствует о том, что P. oleracea представляет собой многообещающий объект для разработки функциональных продуктов питания и натуральных антиоксидантов. Это растение, обладая высокой антиоксидантной активностью, может быть использовано в качестве добавки в пищевые продукты для улучшения их питательной ценности и продления срока хранения. Кроме того, его способность адаптироваться к условиям солевого стресса открывает новые возможности для его использования в агрономии и экологии, особенно в условиях изменяющегося климата и увеличения солености почв.
