Сравнительный морфологический анализ тканей печени данио (Danio rerio), японской медаки (Oryzias latipes) и нотобранхиуса Гюнтера (Nothobranchius guentheri) методами гистоморфометрии и графового моделирования
Сравнительный морфологический анализ тканей печени данио (Danio rerio), японской медаки (Oryzias latipes) и нотобранхиуса Гюнтера (Nothobranchius guentheri) методами гистоморфометрии и графового моделирования
Аннотация
В настоящем исследовании проведен сравнительный анализ гистоарихтектоники печени трех лабораторных видов рыб: данио, японской медаки и нотобранхиуса Гюнтера, являющихся широко используемыми модельными объектами. Для этого был применен комплексный подход, сочетающий классическую гистоморфометрию и графовое моделирование для количественной оценки пространственной организации гепатоцитов. Гистоморфометрический анализ выявил значительные видовые различия в размере и форме ядер гепатоцитов, при этом у нотобранхиуса наблюдались наибольшие значения площади (17,59 мкм²), периметра (17,03 мкм) и диаметра Фере (6,02 мкм). Графовый анализ, основанный на триангуляции Делоне и методе k-ближайших соседей, показал, что ткань печени данио характеризуется разреженной организацией гепатоцитов в виде небольших, удаленных друг от друга кластеров. В отличие от этого, у медаки и нотобранхиуса гепатоциты формировали более плотные и связанные клеточные кластеры. Анализ главных компонент (PCA) успешно разделил три вида на отдельные кластеры, подтвердив, что основной вклад в различия вносят морфометрия ядер и топологические метрики сети (расстояние до соседей, модулярность). Результаты демонстрируют, что интеграция графового моделирования с гистоморфометрией предоставляет мощный инструмент для детальной и количественной характеристики видоспецифических особенностей тканевой архитектуры рыб.
1. Введение
Гистологический анализ является ключевым методом для фенотипической характеристики организмов на тканевом и клеточном уровнях. Он широко применяется для оценки воздействия экзогенных факторов на организм, а также незаменим в сравнительно-анатомических исследованиях, направленных на выявление уникальных морфологических адаптаций, развивающихся в ходе филогенеза и онтогенеза. Внедрение цифровых технологий значительно повысило качество гистологического анализа, обеспечив извлечение беспрецедентного объема информации из гистологических образцов посредством комплексных методов анализа изображений
, . К настоящему времени разработан широкий спектр алгоритмов обработки гистологических изображений, позволяющих определять морфологические и колориметрические характеристики клеток и морфофункциональных единиц , . Тем не менее многоуровневая сложность биологических образцов, обусловленная видовой и индивидуальной изменчивостью, а также особенностями гистологической проводки и окрашивания, создает существенные препятствия для их широкого внедрения в рутинную исследовательскую и диагностическую практику .Печень рыб является ключевым метаболическим центром организма, ответственным за обмен белков, углеводов и липидов, регуляцию гомеостаза, а также за детоксикационную функцию
. По этим причинам морфологическое и функциональное состояние печени широко используется в качестве биомаркеров при оценке физиологического статуса организма и изучении безопасности фармакологических субстанций . Для высших позвоночных существует значительное разнообразие подходов с применением методов цифровой патологии, позволяющих оценивать как общее состояние ткани, так и пространственные и текстурные характеристики изображения , . Особый интерес представляет применение теории графов для описания состояния тканей печени, поскольку оно позволяет устанавливать взаимосвязи между структурой и функцией тканей на гистологических срезах, а также более полно классифицировать фенотипы клеток , , . Кроме того, использование графов для извлечения признаков из гистологических изображений способствует созданию более продвинутых алгоритмов глубокого обучения .Модельные организмы являются фундаментальным инструментом для получения биологических данных в различных областях, позволяя экстраполировать результаты на иные системы
. Благодаря быстрому развитию, высокой плодовитости и простоте содержания некоторые виды рыб служат важными модельными организмами. К наиболее распространенным из них относятся данио рерио (Danio rerio) , японская медака (Oryzias latipes) , гуппи (Poecilia reticulata) , трёхиглая колюшка (Gasterosteus aculeatus) и короткоживущие карпозубообразные (Nothobranchius ssp.) , . Данные виды широко применяются в общебиологических, токсикологических, экотоксикологических, и биомедицинских исследованиях.Несмотря на широкое использование модельных рыб в качестве мощного инструмента в биологических исследованиях, существует риск упрощенной экстраполяции данных, полученных на данных организмах. Распространенная парадигма восприятия рыб как «водных аналогов» грызунов не в полной мере учитывает их уникальную биологию, включая особенности гистоархитектоники тканей, эктотермную природу и специфичность метаболизма
, . Эти различия накладывают существенные ограничения на прямое использование алгоритмов сегментации и извлечение признаков, валидированных на гистологических препаратах млекопитающих. Таким образом, для получения объективных и воспроизводимых результатов требуется создание специализированных подходов к анализу изображений, учитывающих специфику гистологии рыб.Целью исследования является сравнительный анализ гистоарихтектоники печени трех модельных видов рыб: данио (Danio rerio), японской медаки (Oryzias latipes) и нотобранхиуса Гюнтера (Nothobranchius guentheri) с использованием гистоморфометрии и графового моделирования с целью установления видовых особенностей организации ткани.
2. Методы и принципы исследования
В исследовании были задействованы самцы данио (Danio rerio WT, 2,2±0,2 см, 0,30±0,04 г), японской медаки (Oryzias latipes HNI, 2,3±0,1 см, 0,27±0,03 г) и нотобранхиуса Гюнтера (Nothobranchius guentheri Zanzibar TAN 14-02, 3,3±0,4 см, 0,73±0,05 г) в возрасте 4–5 месяцев. Выбор самцов обусловлен половыми различиями в метаболизме этих видов рыб, оказывающими существенное влияние на гистологическую структуру печени
.Данио и медака содержались в 300-литровых аквариумах (200 особей/аквариум) с системами механической и биологической фильтрации и ежедневной 10% заменой воды (22,0±0,8°C, pH 7,3±0,2). Кормление осуществлялось коммерческим кормом Tetra Min Flakes XL. Особи нотобранхиуса содержались группами (20–25 особей обоего пола) в 50-литровых аквариумах (21,0±0,5°C, pH 7,4±0,1) с постоянной аэрацией и регулярной заменой воды: частичной (каждые 2 дня) и полной (каждые 7 дней). Рыб кормили живым кормом (Daphnia magna, личинки Chironomidae, Artemia salina). Содержание и уход за всеми видами рыб осуществлялись в соответствии с опубликованными рекомендациями
, , , .Для получения гистологических срезов рыб отбирались по 12 особей каждого вида, из которых изготавливалось по 3 среза (n = 12×3). Рыба седатировалась в растворе MS-222 (10 мг/л), фиксировали 24 ч в растворе Дэвидсона, затем переносили в 70% этанол до дальнейшей обработки. Образцы ткани проводились через ряд последовательно возрастающих концентраций спирта — этанол (1 час, 80% — 1 час, 95% — 1 час и 99% — два раза по 1 часу) (Citadel 2000, Thermo FS, США). После этого образцы просветляли в ксилоле в течение 1,5 часов и выполняли заливку в парафин. Из образцов изготавливали по три микротомных серийных среза (Minux S700A, RWD Life Science, Китай) толщиной 4 мкм, окрашивали гематоксилин-эозином (H&E) (Biovitrum, Россия). Подготовка и окрашивание гистологических срезов соответствовали общепринятой методике . Полученные препараты просматривали под световым микроскопом Olympus BX53 (Olympus Corp., Япония) с окулярными насадками CarlZeiss ERc 5s (Zeiss, Германия) и ToupCam 16.0 MP (ToupTek Photonics, Китай) и использованием программного обеспечения ZEN lite (Zeiss, Германия) и ToupCam view 16.0 (ToupTek Photonics, Китай). Adobe Photoshop 2024 (Adobe Systems, США) использовался для настройки таких параметров изображений, как яркость, контрастность и баланс освещенности.
После предварительного гистологического скрининга, для дальнейшего исследования были отобраны наиболее качественные гистологические срезы печени рыб. С каждого среза было получено не менее 15 микрофотографий различных участков тканей печени при увеличениях объектива ×10 и ×40.
При получении изображений использовались стандартизированные настройки освещения и конденсора, оптимизированные для достижения максимальной контрастности. Изображения в формате .tiff были нормализованы с использованием программы Fiji ImageJ2 v2.15.0 посредством алгоритма «Выравнивание среднего фона по каналам» и пользовательского скрипта. Общая схема обработки гистологических изображений приведена на рисунке 1.
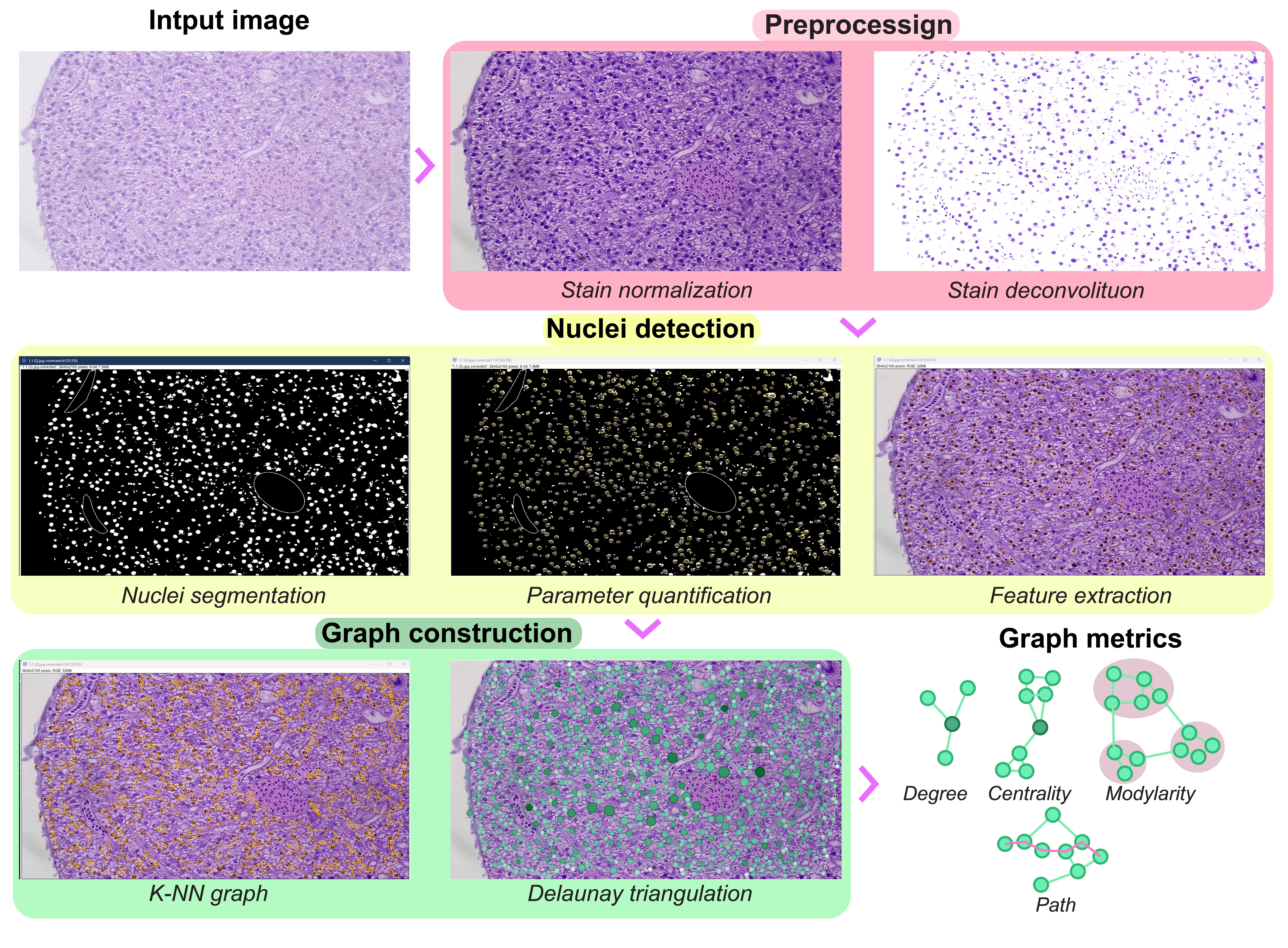
Рисунок 1 - Схема количественного анализа тканевой архитектоники на основе комбинированного морфометрического и топологического подходов с использованием графового моделирования на примере печени дани
Цветовая деконволюция для разделения компонентов гематоксилина и эозина на изображениях печени данио выполнялась с использованием алгоритма, описанного Macenko et al.
, в программе QuPath v0.6 . Для изображений печени медаки и нотобранхиуса деконволюция выполнялась с применением классификации пикселей в QuPath, обученной на основе аннотированных областей ядер и стромы органа.Идентификация отдельных ядер гепатоцитов выполнялась с использованием полуавтоматического алгоритма сегментации в программе Fiji ImageJ2. Сначала деконволюированные цветные изображения (канал гематоксилина для ядер) были преобразованы в 8-битный формат оттенков серого. Для снижения уровня шума применялось размытие по Гауссу с радиусом 2,0 пикселей. При дальнейшем анализе на изображениях не учитывались крупные сосуды и желчные протоки. Затем ядра на изображении сегментировались с помощью функции «Analyze Particles» после применения автоматической пороговой обработки. Для каждого сегментированного ядра фиксировались координаты его центроида (X, Y). Помимо пространственных координат, для каждого ядра был рассчитан набор морфометрических параметров, включая: площадь, периметр, большую и малую оси вписанного эллипса, диаметр и угол Фере, округлость, циркулярность и плотность. Данные параметры использовались для характеристики морфологии клеток. С целью минимизации влияния крайних значений (выбросов) из дальнейшего анализа были исключены данные, находящиеся ниже 5-го и выше 95-го персентилей. Для оценки эффективности сегментации на наборе из 36 изображений (n = 6×6) был выполнен ручной подсчет ядер. Полученные данные впоследствии сопоставлялись с результатами, полученными алгоритмом.
Пространственная организация гепатоцитов была смоделирована как двумерный неориентированный граф, где центроиды ядер представляли вершины, а связи (рёбра) между вершинами устанавливались методами триангуляции Делоне и k-ближайших соседей (k = 3). Определение ближайших соседей и визуализация графа выполнялись на основе алгоритма, описанного Haeri & Haeri
, с применением модифицированного скрипта Damon Poburko . Граф k-ближайших соседей применялся для определения некрупных кластеров клеток и расчета гистоморфометрических подателей. Для данного типа сетей расчет метрики графа не производился.Триангуляция Делоне была выбрана ввиду её способности идентифицировать «естественных соседей» в наборе точек на основе их пространственной близости, что позволяет эффективно моделировать цитоархитектонику ткани
. Построение графов выполнялось с использованием оригинального скрипта на языке Python с библиотекой SciPy . Полученные данные графов для каждого изображения, включая координаты вершин и списки рёбер, сохранялись для последующего анализа.Топологические свойства полученных графов были количественно охарактеризованы с использованием программного обеспечения с открытым исходным кодом Gephi 0.10.1 . Для каждого графа был рассчитан комплекс сетевых метрик, характеризующих архитектуру ткани на локальном и глобальном уровнях:
(i) метрики уровня вершин: степень, центральность по посредничеству, коэффициент кластеризации;
(ii) метрики уровня графа: плотность графа, средняя длина пути, модулярность.
Данные сравнения анализируемых переменных представлены в виде средних ± SD. Статистическая достоверность определялась с использованием параметрических тестов (t-критерия Уэлча, дисперсионный анализ (ANOVA) с последующим пост-хок тестом Тьюки) при условии нормальности данных и однородности вариаций (тесты Шапиро-Уилка и Левена). Значение p <0,05 было принято, как статистически достоверное. Для визуализации взаимосвязей между экспериментальными группами и измеренными переменными был проведен анализ главных компонент (PCA) с использованием языка программирования R и пакетов FactoMineR и factoextra . Статистическая обработка и визуализация данных производилась с использованием GraphPad Prism v 9.0 (GraphPad, San Diego, CA, USA) и в среде RStudio v 3.6.0 (RStudio, PBC, Boston, MA) с использованием языка программирования R v 4.4.3 .
3. Основные результаты
Печеночная ткань трех видов рыб состояла из гепатоцитов, организованных в анастомотические дольки, разделенные синусоидными капиллярами, содержащими небольшое количество эритроцитов. В ткани также присутствовали крупные кровеносные сосуды и желчные протоки (рис. 2a-c). Гепатоциты самцов данио демонстрировали признаки вакуолизации, проявляющиеся наличием в их цитоплазме амфифильных участков с неровными краями (рис. 2a). В отличие от этого, гепатоциты медаки и нотобранхиуса обладали плотной эозинофильной цитоплазмой и крупным ядром с четко выраженными ядерными границами и ядрышком (рис. 2b, c).
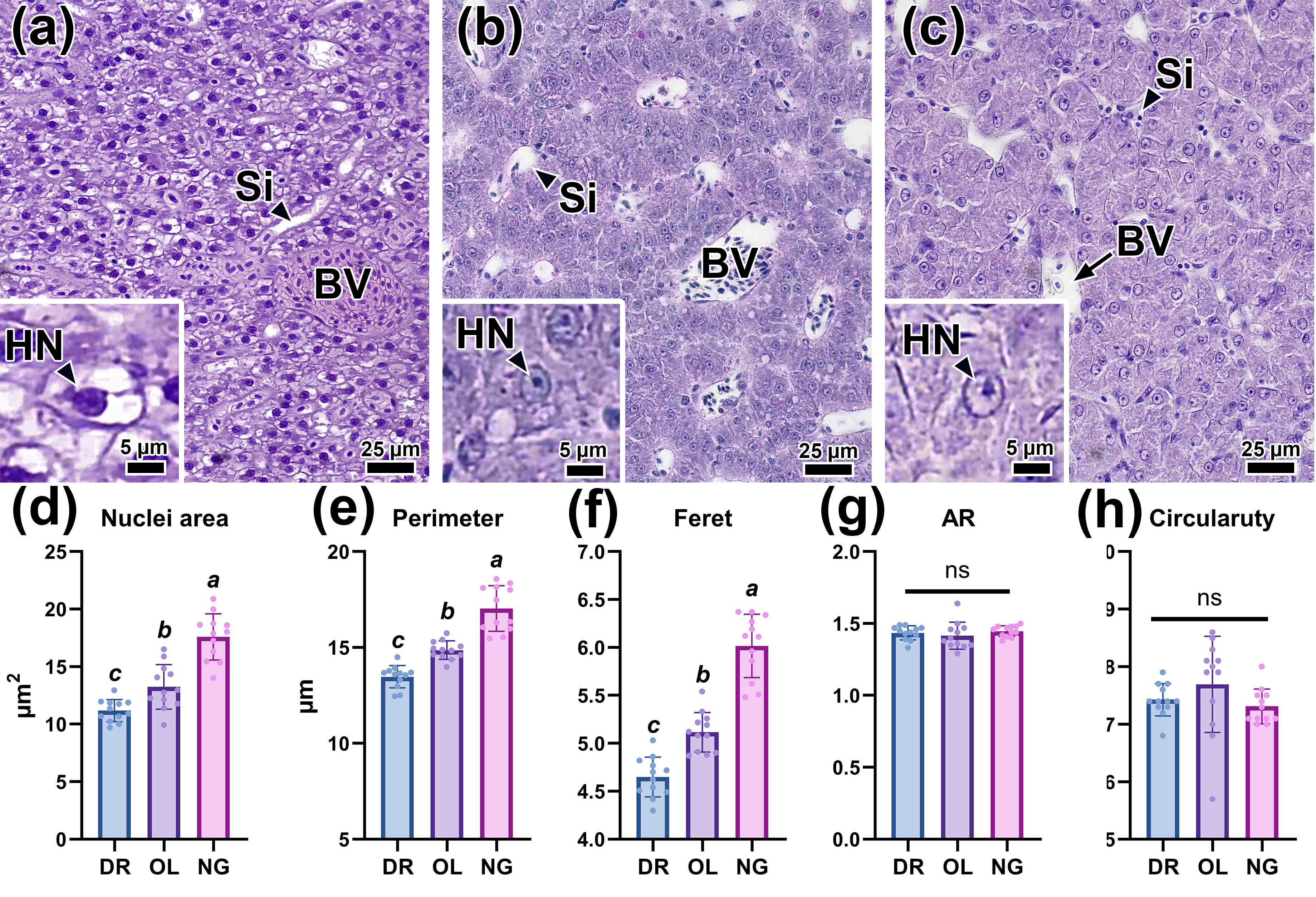
Рисунок 2 - Гистология печени данио (а), японской медаки (b) и нотобранхиуса Гюнтера (c), а также морфометрические показатели ядре гепатоцитов (d-h)
Примечание: сокращения: Si – синусоидный капилляр, BV – кровеносный сосуд, HN – ядро гепатоцита. Окраска H&E, шкала масштаба 5 и 25 мкм. Надстрочные буквы (a, b, c) указывают на статистическую значимость (p <0,01, 0,05) из дисперсионного анализа (ANOVA) с последующим пост-хок тестом Тьюки
Гистоморфометрический анализ ядер гепатоцитов выявил, что самцы нотобранхиуса демонстрировали достоверно наибольшие значения площади (17,59 мкм2), периметра (17,03 мкм) и диаметра Фере (6,02 мкм) (p <0,01 на рис. 2d-f). Гепатоциты медаки, в свою очередь, по данным показателям достоверно отличались как от данио, так и от нотобранхиуса (p <0,05). Аналогичные различия были также установлены для параметров большой и малой осей вписанного эллипса ядер гепатоцитов. Однако достоверных различий по показателям соотношения сторон (AR; 1,41–1,45), округлости (0,72–0,74) и циркулярности (0,73–0,77) выявлено не было (рис. 2g, h). Показатель плотности (Solidity) также характеризовался относительно гетерогенностью для исследованных видов.
Анализ графа k-ближайших соседей (k = 3), построенного на основе извлеченных признаков ядер гепатоцитов, выявил существенные различия между исследуемыми видами. У данио гепатоциты были организованы в небольшие, преимущественно перисинусоидальные кластеры, значительно удаленные друг от друга (рис. 3a, b). Это соответствовало достоверно большему расстоянию (p <0,05) до 3-го ближайшего соседа у данного вида (рис. 3i).
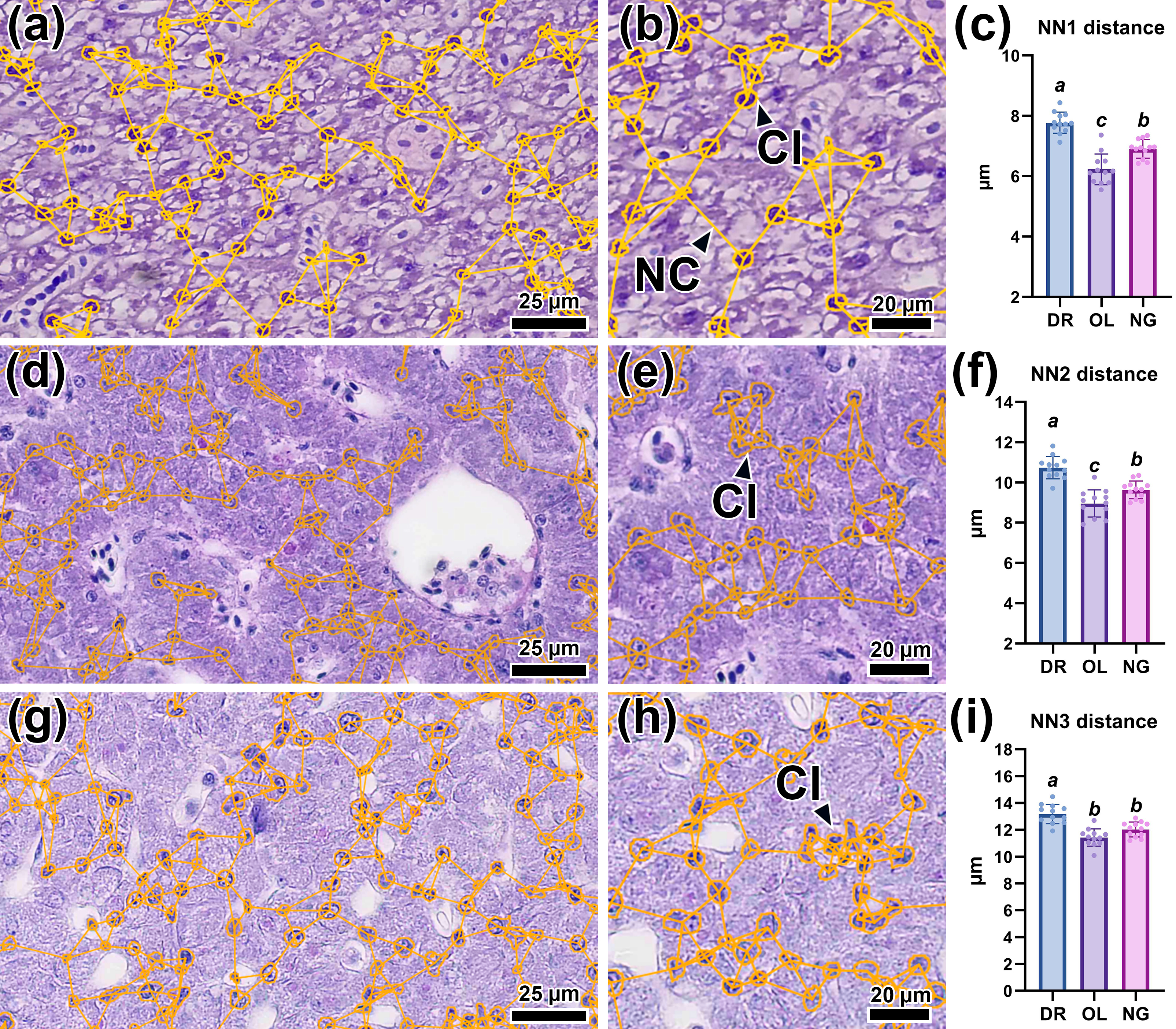
Рисунок 3 - Граф k-ближайших соседей (k = 3) для гепатоцитов печени данио (а, b), японской медаки (d, e) и нотобранхиуса Гюнтера (g, h), а также показатели расстояния до трех ближайших соседей (c, f, i)
Примечание: сокращения: Cl – кластер, NC – связь соседства (Neighbourhood connection). Окраска H&E, шкала масштаба 5 и 25 мкм. Надстрочные буквы (a, b, c) указывают на статистическую значимость (p <0,01, 0,05) из дисперсионного анализа (ANOVA) с последующим пост-хок тестом Тьюки
Построение графов методом триангуляции Делоне подтвердило ранее выявленные топологические различия в печеночной ткани трех видов рыб. Было установлено, что гепатоциты с высокой степенью (degree >5) и высокой центральностью по посредничеству (Betweenness Centrality >10000) локализовались вблизи крупных кровеносных сосудов (рис. 4e, h). Эта особенность была наиболее выражена в печеночной ткани данио (рис. 4a, b). Такие узлы идентифицируются как «клетки-мосты», что подчеркивает их структурную значимость. При этом по показателю средней степени вершин пространственные графы данио демонстрировали значительно более низкие значения по сравнению с двумя другими видами (рис. 5а). Вершины, характеризующиеся низкой степенью и низкой центральностью по посредничеству, образовывали плотные скопления по периферии компактных клеточных кластеров, что в совокупности указывает на их ограниченную структурную значимость для сети.
Отличительной особенностью пространственной организации гепатоцитов медаки и нотобранхиуса являлось наличие узлов, характеризующихся низкой степенью, но высокой центральностью (рис. 4f, i). Эти узлы можно интерпретировать как локальные участки высокой клеточной плотности. Кроме того, сеть гепатоцитов печени медаки демонстрировала наибольшие значения средней длины пути, диаметра сети и модулярности (рис. 5d-f) по сравнению с данио (p <0,01) и нотобранхиусом (p <0,05). Печень нотобранхиуса также характеризовалась большей фрагментарностью сети и меньшим количеством хабов (рис. 4g). Однако средний коэффициент кластеризации (0,437–0,444) и плотность сети (0,009–0,011) не имели статистически значимых различий между исследуемыми видами (рис. 5e).
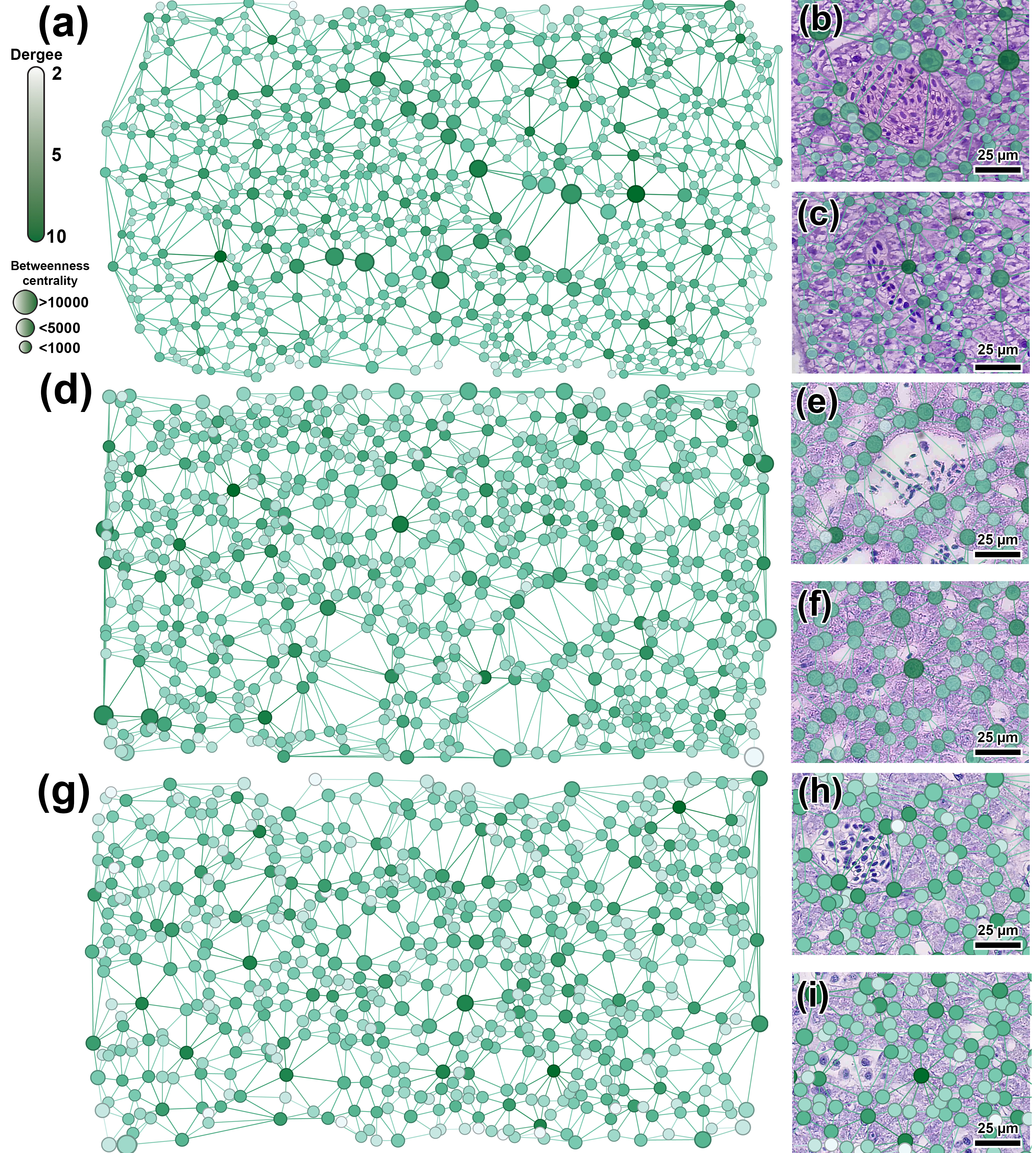
Рисунок 4 - Топологический анализ организации ядер гепатоцитов на основе пространственных графов и репрезентативные гистологические изображения с наложенными на них соответствующими сегментами графа данио (а-с), японской медаки (d-f) и нотобранхиуса Гюнтера (g-i)
Примечание: примечание: цвет вершин графа отражает их степень (количество соседей), а размер пропорционален центральности по посредничеству. Окраска H&E, шкала масштаба 25 мкм
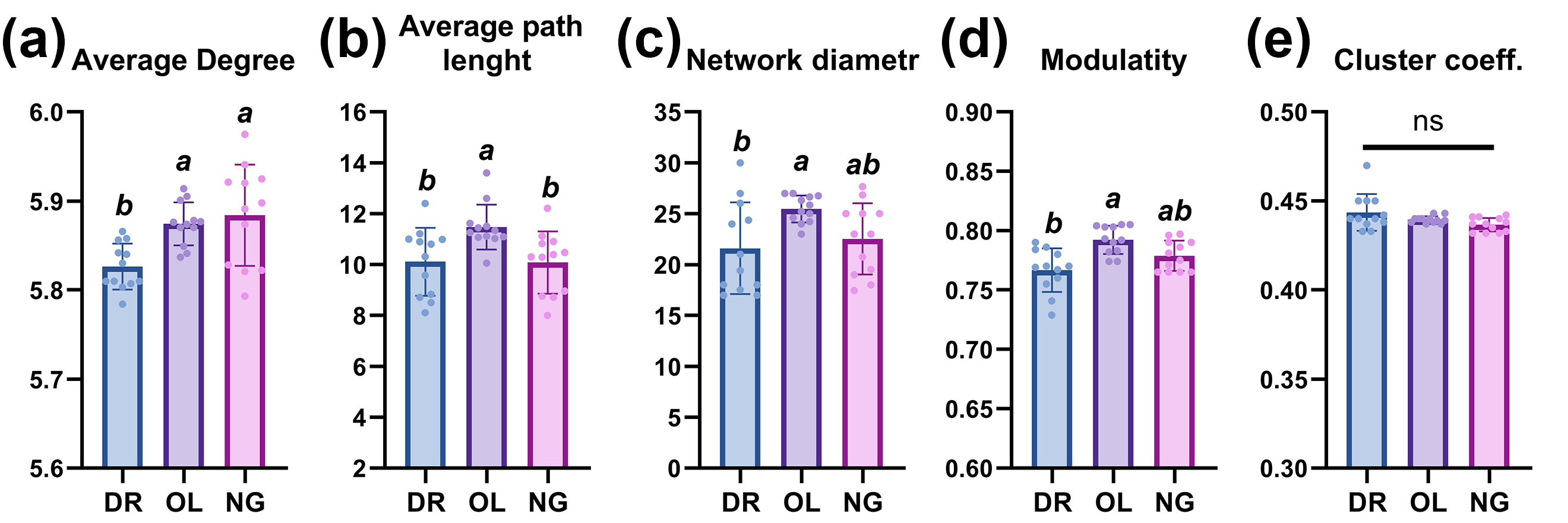
Рисунок 5 - Основные метрики графов ядер гепатоцитов трех видов рыб
Примечание: надстрочные буквы (a, b, c) указывают на статистическую значимость (p <0,01, 0,05) из дисперсионного анализа (ANOVA) с последующим пост-хок тестом Тьюки
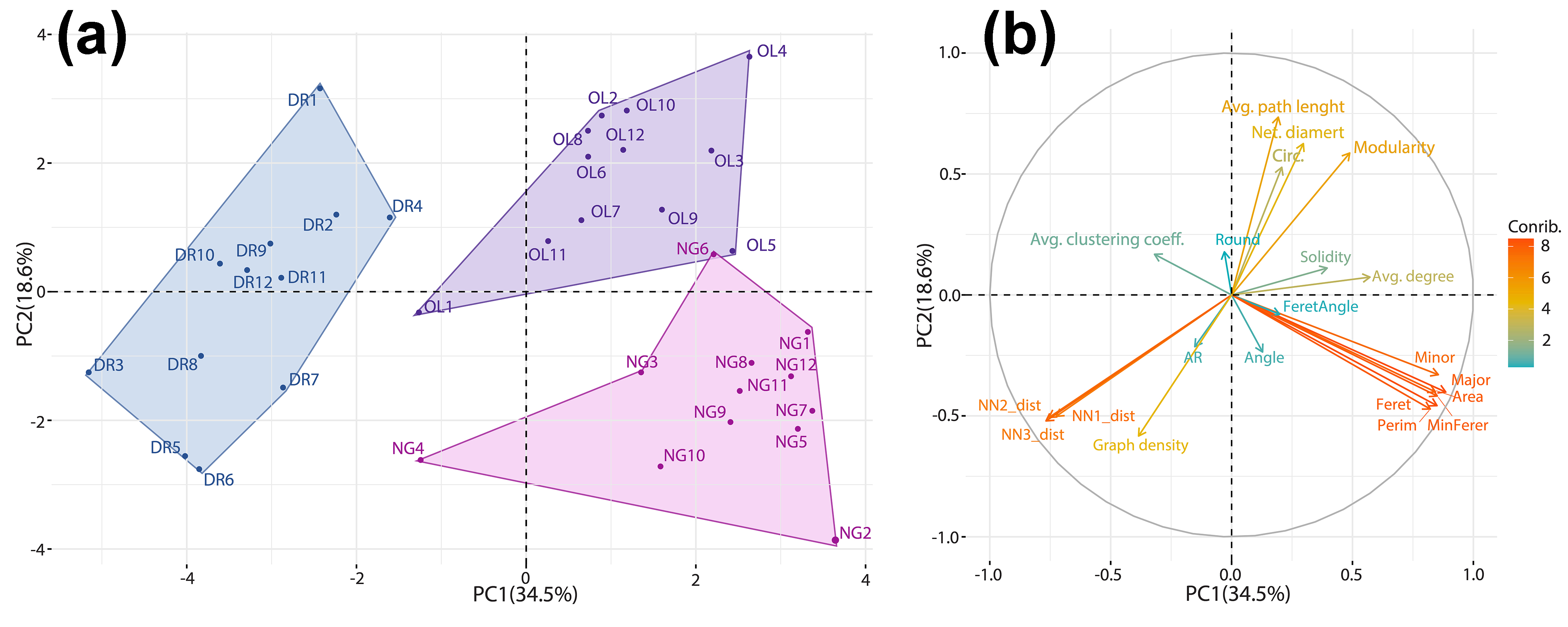
Рисунок 6 - Результаты анализа главных компонент (PCA) на основе гистоморфометрических и метрики графов ядер гепатоцитов трех видов рыб: Диаграмма счетов (scores plot) (а) и диаграмма нагрузок (loadings plot)
Примечание: цвет и длина векторов отражают величину вклада (Contrib.) каждой переменной
4. Обсуждение
Пищеварительная система рыб демонстрирует значительное морфологическое разнообразие, что является адаптацией к различным условиям среды и питания. Морфологические особенности тканей, выявленные в настоящем исследовании, согласуются с ранее опубликованными данными. В частности, выраженная вакуолизация гепатоцитов здоровых особей данио ранее описывалась
, и может быть обусловлена спецификой углеводного метаболизма и депонирования .Более плотная структура гепатоцитов медаки и нотобранхиуса, вероятно, объясняется как видовыми особенностями метаболизма, так и лабораторными условиями питания. В частности, поскольку нотобранхиус неохотно потребляет искусственные корма, их рацион преимущественно состоит из живых кормов . В свою очередь, больший размер гепатоцитов (по площади, периметру и другим морфометрическим показателям) у нотобранхиуса коррелирует с тем, что в возрасте 4 месяцев самцы этого вида достигают значительно больших размеров (2,9–3,2 см) по сравнению с данио и медакой (2,0–2,4 см), как это было показано ранее
.Представленный в настоящем исследовании метод сегментации и извлечения признаков гистологических изображений печени рыб доказал свою эффективность, обеспечив характеристику как гистоморфометрических особенностей, так и топологических различий трех модельных видов. Ранее описанные алгоритмы анализа гистологических изображений печени, разработанные для высших позвоночных
, , неприменимы к тканям печени рыб из-за их специфических особенностей, выявленных в настоящей работе: выраженной вакуолизации, неравномерной окраски ядер, своеобразия организации сосудистой сети и вариабельности морфометрических параметров.Тем не менее предложенный алгоритм имеет ряд ограничений, которые следует учитывать при его применении:
(i) необходимость нормализации окраски для эффективной деконволюции;
(ii) требование ручного исключения областей, содержащих сосуды и желчные протоки;
(iii) критичность использования достаточного числа биологических повторностей (n > 6) и тщательного анализа данных для обеспечения достоверности результатов. Эти ограничения подчеркивают необходимость развития более совершенных алгоритмов глубокого обучения для повышения эффективности сегментации и извлечения признаков. Дополнительно, выполнения построение графов на основе отдельных полей зрения гистологических препаратов, ограничивает полноту анализа и приводит к появлению артефактов (краевой эффект). В рамках дальнейших исследований планируется усовершенствовать алгоритм сегментации, а также выполнить графовое моделирование на основе полнослайдового сканирования гистологических препаратов рыб.
Традиционный анализ гистологических изображений включает визуальную оценку морфологических изменений, особенностей организации и топологии тканей, проводимую специалистами-гистологами
. Применение теории графов в гистологических исследованиях позволяет преобразовать качественные признаки в количественные характеристики, поддающиеся статистическому сравнению и анализу. В настоящем исследовании применение триангуляции Делоне и метода k-ближайших соседей для описания топологии печени трех модельных видов рыб позволило выявить как выраженные сходства (в частности, локализацию высокосвязанных гепатоцитов с высокой центральностью посредничества вблизи крупных кровеносных сосудов и синусоидов), так и видовые различия в организации ткани печени (например, степень разреженности и кластеризации гепатоцитов).Выявленные различия, вероятно, обусловлены уникальной экологией каждого вида рыб. Данио (Cypriniformes) и медака (Beloniformes) — типичные всеядные виды, обитающие в мелководных прудах и медленно текущих реках
, . Печень этих рыб демонстрирует типичную шнуровидную организацию гепатоцито-синусоидальных структур , характеризующуюся высокой пластичностью и регенеративной способностью. Для медаки были установлены значительно более высокие показатели средней степени и длины пути, что может свидетельствовать о большей компактности органа.Напротив, нотобранхиус (Сyprinodontiformes) обитает в пересыхающих водоемах и имеет преимущественно плотоядный тип питания
. Это отразилось на организации ткани печени, которая, относясь к шнуровидной форме, тем не менее характеризуется более высокой плотностью ткани (высокие значения средней степени) при относительно невысокой компактности (сравнимые с данио значения длины пути и диаметра сети). Эти особенности могут быть объяснены высокой функциональной нагрузкой на печень, обеспечивающей высокую скорость метаболизма, необходимую для успешного развития и размножения в экстремальных условиях .Комплексный анализ полученных результатов показал, что наиболее вариабельными признаками, отражающими межвидовые различия, являются как гистоморфометрические показатели ядер гепатоцитов (площадь, периметр и др.), Комплексный анализ полученных результатов показал, что наиболее вариабельными признаками, отражающими межвидовые различия, являются как гистоморфометрические показатели ядер гепатоцитов (площадь, периметр и др.), так и топологические характеристики (модулярность, длина пути, расстояние между соседями). Ранее было многократно продемонстрировано, что использование морфометрии позволяет выявлять специфические различия, неочевидные при стандартном гистологическом анализе , , . В данном контексте, совмещение классических морфометрических методов исследования с методами графового моделирования обеспечивает получение более точных данных о тканевой архитектуре печени. Это может быть использовано как в сравнительно-анатомических исследованиях, так и для оценки воздействия экзогенных факторов на организм
5. Заключение
1. Гепатоциты самцов нотобранхиуса Гюнтера обладают достоверно наибольшими морфометрическими параметрами ядер, включая площадь (17,59 мкм²), периметр (17,03 мкм) и диаметр Фере (6,02 мкм), по сравнению с данио и медакой.
2. Пространственная организация гепатоцитов у данио характеризуется формированием небольших, преимущественно перисинусоидальных кластеров, значительно удаленных друг от друга, в то время как у медаки и нотобранхиуса гепатоциты организованы в более плотные и крупные кластеры с меньшим межклеточным расстоянием.
3. Граф гепатоцитов печени медаки демонстрирует наибольшие значения средней длины пути, диаметра сети и модулярности по сравнению с данио и нотобранхиусом, что указывает на более сложную и сегментированную топологическую структуру ткани.
4. Анализ главных компонент (PCA) позволил эффективно разделить три вида рыб на непересекающиеся кластеры, объяснив 53,1% общей дисперсии данных. Разделение было обусловлено вкладом параметров размера ядер (для нотобранхиуса), сетевых метрик (модулярность и длина пути для медаки) и показателей расстояний между клетками (для данио).
5. Сочетание гистоморфометрии с графовым моделированием является мощным инструментом для количественной оценки тканевой архитектуры, позволяя выявлять невыраженные видоспецифические различия в организации печени, которые не очевидны при стандартном гистологическом анализе.
