СОСТАВ БЕЛКОВ В РЕПРОДУКТИВНЫХ ОРГАНАХ И ТКАНЯХ МОЖЖЕВЕЛЬНИКА ОБЫКНОВЕННОГО (JUNIPERUS COMMUNIS L.) И ИХ РОЛЬ В ИНТЕРАКЦИИ МУЖСКОГО И ЖЕНСКОГО ГАМЕТОФИТОВ
СОСТАВ БЕЛКОВ В РЕПРОДУКТИВНЫХ ОРГАНАХ И ТКАНЯХ МОЖЖЕВЕЛЬНИКА ОБЫКНОВЕННОГО (JUNIPERUS COMMUNIS L.) И ИХ РОЛЬ В ИНТЕРАКЦИИ МУЖСКОГО И ЖЕНСКОГО ГАМЕТОФИТОВ
Аннотация
Методами 1-D электрофореза по Лэмли (SDS-PAGE), 2-D электрофореза (IEF – SDS-PAGE) и методом масс-спектрометрии с матрично-активированной лазерной ионизацией (МАЛДИ) с последующей обработкой МАЛДИ масс-спектров путем использования библиотеки Mascot изучали состав белков в репродуктивных органах, тканях и субстанциях можжевельника обыкновенного. Состав белков определяли в тканях нуцеллуса, ядерного и клеточного гаметофитов (до и после оплодотворения), в семязачатках на стадии профазы I мейоза макроспороцитов, в пыльцевых трубках и в опылительной капельке. Состав белков в разных репродуктивных органах, тканях и субстанциях у можжевельника существенно различается. Белки клеток нуцеллуса, по-видимому, играют определяющую регуляторную функцию в интеракции мужских и женских репродуктивных структур в онтогенезе, участвуют в процессах регуляции клеточной дифференциации и морфогенеза в эмбриональных тканях можжевельника. В целом, состав белков в репродуктивных органах и тканях у можжевельника весьма разнообразен и отражает функциональные особенности этих структур.
1. Введение
У голосеменных растений в семязачатках отсутствует проводниковая ткань. Между тем процессы гистогенеза мужских и женских репродуктивных структур у них строго скоординированы, что подтверждается многочисленными экспериментами по искусственному опылению. Вероятно, ведущую роль в интеракции мужского и женского гаметофитов играет пыльцевая трубка, которая способна расти и развиваться автономно, тогда как женский гаметофит чаще всего не может функционировать самостоятельно. При отсутствии опыления развитие женского гаметофита прерывается уже на ранних стадиях, еще до начала мейоза материнской клетки макроспор, или в начале свободно-ядерных делений. В этом случае после дегенерации женского гаметофита происходит деградация клеток нуцеллуса в его халазальной, а затем и в микропилярной зонах, дегенерация и некроз всего семязачатка. Клетки центральной зоны нуцеллуса, морфологически не отличающиеся от других клеток этой ткани, но разделяющие друг от друга сначала оба развивающихся гаметофита, а затем и мужские и женские половые клетки, несомненно, должны участвовать в сигнальных связях между ними, начиная с момента опыления и до оплодотворения. Очевидна, хотя и не понятна, роль белков в этих процессах. Непонятны и сами механизмы кодирования, передачи и считывания такой информации. Удивительно, но какие-либо публикации об участии и роли белков во взаимной интеракции параллельно развивающихся мужского и женского гаметофитов у голосеменных растений отсутствуют. Целью работы являлось изучение белкового состава и теоретическое обоснование возможной роли белков в онтогенезе репродуктивных органов и тканей можжевельника.
2. Методы и принципы исследования
Семязачатки можжевельника 2-го и 3-го года жизни на разных стадиях онтогенеза препарировали под бинокуляром МБС-10. Отдельно извлекали мегагаметофиты на нуклеарной и целлюлярной стадиях, нуцеллусы. Семязачатки 2-го года освобождали от покровных чешуй и далее не препарировали. Кроме того, для анализа были взяты образцы пыльцы, пыльцевых трубок и опылительной капельки можжевельника. Состав экстрагирующего буфера подбирали эмпирически. Лучшие результаты были достигнуты при гомогенизации в diH2O с 0,1М конечной концентрацией дитиотрейтола, без добавления детергентов. Для ингибирования протеаз в состав буфера вводили апротинин. Гомогенизацию проводили механическим способом в охлажденных ступках путем замораживания-оттаивания. После ночного экстрагирования в холодильнике лизаты центрифугировали при 14 тыс. об./мин. в течение 15 мин. Супернатанты замораживали и хранили до использования при -80º С.
1-D электрофорез по Лэмли (SDS-PAGE) проводили в ЭФ-камере MiniProtean Tetra Cell (BioRad, США) по протоколам компании BioRad (США). Для ЭФ-разделения белков использовался программируемый источник постоянного тока PowerPac HV (BioRad, США) со стабилизацией по напряжению. Режим работы – постоянное напряжение 150 В. Окрашивание гелевых пластин – Coomassie Brilliant Blue R-250. Молекулярные массы белков после разделения в геле и окрашивания в растворе Кумасси определяли предварительно с помощью смеси маркерных белков, состоящей из 14 высокоочищенных белков массой от 10 до 200 кДа (производитель – Thermo Scientific).
2-D электрофорез (IEF – SDS-PAGE) проводили в ЭФ-камерах MiniProtean Tube Cell (BioRad, США) (изоэлектрофокусировка в гелевых трубочках) и MiniProtean Tetra Cell (BioRad, США) по протоколам компании BioRad. Режим работы при первом разделении – 500 В в течение 10 мин., затем 750 В в течение 3,5 часов. Разделение во втором направлении проводили в режиме постоянного напряжения 150 В. Окрашивание гелевых пластин – Coomassie Brilliant Blue G-250.
После процедуры трипсинолиза состав белков в тканях репродуктивных органов можжевельника изучали методом масс-спектрометрии с матрично-активированной лазерной ионизацией (МАЛДИ). В качестве матрицы использовалась α-циано-4-гидроксикоричная кислота (α-CHCA) (matrix substance for MALDI-MS, ≥ 99,0%; Fluka, Сент-Луис). Использовали следующие растворители: ацетонитрил (сорт 3, Криохром, Россия), трифторуксусную кислоту (TFA) (≥ 99,5%; Fluka, Сент-Луис), а также деионизованную воду с удельным сопротивлением 18,2 мОм/см, полученную в системе Simplicity UV (Millipore, Франция). Раствор матрицы готовили с концентрацией 15 мг/мл в 0,1% TFA с ацетонитрилом в соотношении 1:1. На поверхность лунки помещали 0,5 мкл аналита, затем сразу 0,5 мкл раствора матрицы и высушивали на воздухе.
Масс-спектры МАЛДИ записывались в режиме рефлектрона с использованием тандемного масс-спектрометра Axima Perfomance (Shimadzu-Biotech, Великобритания), оснащенного линейным анализатором и соударительной ячейкой. Использовался азотный УФ-лазер (λ=337 нм) с продолжительностью импульса 3 нс и энергией 60 мДж, работающий с частотой 5 Гц. Для получения спектра аккумулировались данные 200 вспышек лазера (100 профилей по 2 вспышки), собранные с разных точек мишени. Во всех экспериментах мощность лазера составляла 70 у.е, превышая на 20% пороговое значение для ионизации образцов. Калибровка шкалы масс выполнялась с применением смеси пептидов (ProteoMass High Mass Calibration Mix, Sigma-Aldrich, США). Масс-спектры записывались в положительном режиме в диапазоне m/z: 100-50000 Да. Управление масс-спектрометром, сбор и обработка данных осуществлялись при помощи ПО Launchpad, вер. 2.9. Для обработки МАЛДИ масс-спектров использовали библиотеку Mascot .
3. Результаты и обсуждение
Репродуктивные ткани генеративных органов хвойных видов строго функциональны. Состав белков в разных тканях существенно различается.
3.1. Нуцеллус
В тканях нуцеллуса выявлен протеин FRIGIDA, ответственный за регуляцию сроков клеточной дифференциации в репродуктивных органах растений . Кроме того, в нуцеллусах выявлен транскрипционный регулятор, стимулирующий клеточную дифференцировку и морфогенез в эмбриональных тканях. Следует отметить, что ткань нуцеллуса внешне не дифференцирована, за исключением самой ранней стадии развития, когда в ее центральной части обособляются материнские клетки макроспор и формируется губчатая ткань, а в апикальной зоне нуцеллуса появляются секреторные клетки, выделяющие наружу опылительную капельку. Поскольку препарирование семязачатков производилось на более поздних стадиях развития, то можно предположить, что, по-видимому, белки клеток нуцеллуса имеют важную регуляторную функцию в интеракции мужских и женских репродуктивных структур в онтогенезе. В тканях нуцеллуса обнаружены цитохромы С-типа, являющиеся митохондриальнымы гем-белками, регулирующими апоптоз. Возможно, эти белки ответственны за лизис стенок клеток тапетума, но, не исключено также, что они участвуют в последовательном апоптозе клеток в узком коридоре в центральной части нуцеллуса (в направлении от апекса к мегагаметофиту). В большинстве исследований по биологии пыльцевых трубок муссируется тезис о том, что лизис клеток нуцеллуса, контактирующих с растущими кончиками пыльцевых трубок, происходит за счет гидролитических ферментов, выделяемых при экзоцитозе. Однако полученные результаты свидетельствуют о том, что, вероятнее всего, разрушение стенок этих клеток происходит вследствие апоптоза, и лишь затем продукты этого катаболизма лизируют под воздействием ферментов, выделяемых через кончик пыльцевой трубки, и служат питательной средой, необходимой для ее роста и развития. Таким образом, освобождается пространство, необходимое для продвижения кончика растущей трубки строго по направлению к женскому гаметофиту. Следовательно, узкая зона нуцеллуса, клетки которой морфологически никак не отличаются от остальных клеток нуцеллуса, выполняет функцию проводниковой ткани, обеспечивая сигнальную связь между мужским и женским гаметофитами на всех этапах их взаимодействия за счет транс-мембранных и мембранно-связанных белков (митохондриальной транс-мембранной транслоказы, гликозилтрансферазы, глутамил аминопептидазы, сигнальных пептидаз).
3.2. Пыльцевые трубки
В пыльцевых трубках выявлены белки, являющиеся компонентами клеточных мембран очень низкой плотности (холин) и факторы сборки и вставки бета-баррельных белков в наружные мембраны. Встроенные мембранные белки являются важным фактором не только для роста кончика пыльцевой трубки, но и, по-видимому, для приемки-передачи сигнала извне и вовне. В пыльцевых трубках идентифицированы ферменты, катализирующие метаболизм аминокислот, сахаров, аминосахаров, а также белки сборки липополисахаридов и биосинтеза липидов (тетратрикопептид протеин).
Вопрос ядерных взаимосвязей в пыльцевых трубках растений затрагивался не раз . Сложная морфологическая связь между генеративной клеткой и вегетативным ядром в прорастающей пыльце у покрытосеменных впервые была установлена на примере видов р. Rhododendron путем трехмерной реконструкции пыльцевых трубок по ультратонким срезам . В пыльцевых трубках голосеменных цитоплазматический тяж между ядрами был описан для Taxus yunnanensis . В пыльцевых трубках можжевельника обыкновенного морфологические структуры, которые могли бы связывать оба ядра, не просматриваются.
Сигнальные связи внутри пыльцевой трубки (между генеративным ядром и ядром клетки трубки) осуществляются посредством белков классов внутриклеточных калиевых и кальциевых каналов и, вероятно, за счет редокс-сигналинга (металл-зависимые фосфогидролазы, глутамил аминопептидаза, фосфопируват гидратаза). Передача сигнала через мембрану кончика трубки происходит, вероятно, с участием фермента гистидин киназы. Восприятие сигнала извне, возможно, происходит за счет интегральных мембранных белковых комплексов (пептидаза М1). Эти белки, вероятно, могут участвовать и в передаче сигнала в клетки нуцеллуса. Внутриклеточная дифференциация и морфогенез в пыльцевых трубках стимулируется транскрипционными регуляторами.
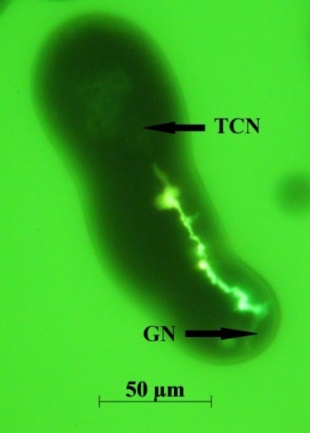
Рисунок 1 - Флуоресцирующая дорожка в теле трубки может служить доказательством существования канала редокс-сигнальной связи между ядром клетки трубки и генеративным ядром в пыльцевой трубке можжевельника:
TCN – ядро клетки трубки; GN – генеративное ядро
В последнее время роль АФК в биологических процессах, в том числе редокс-сигналинг, широко обсуждаются. Функции АФК в передаче сигналов внутри растительной клетки трактуются неоднозначно. Неясно, являются ли АФК мессенджерами, индуцирующими новые специфичные сигнальные системы, или регуляторами, управляющими известными сигнальными путями. Потенциальные белки-мишени не обладают специфичностью ни к одной из форм АФК, однако H2O2 соответствует ряду критериев вторичных мессенджеров .
Согласно концепции компартментализации, «колокализация многокомпонентных сигнальных комплексов осуществляется через белковые каркасы, которые позволяют достичь большей специфичности, чем в случае простой диффузии того же набора участников процесса» . Установлено, что АФК, продуцируемые мембранной НАДФH-оксидазой (NOX), активируют Ca2+-каналы , . Считается, что основную роль в функционировании АФК-зависимых сигнальных систем растительной клетки играют редокс-регуляторы, протеинкиназы и протеинфосфатазы, а также факторы транскрипции , и, возможно, баланс редокс-пар . Роль актинового цитоскелета в АФК-сигналинге можно, вероятно, с определенными оговорками, рассматривать в качестве фактора компартментализации.
Отсутствие морфологически выраженной связи между ядрами в пыльцевой трубке можжевельника не означает отсутствие между ними связи как таковой. Эта связь жизненно необходима для полноценного функционирования пыльцевой трубки в онтогенезе, когда ядро клетки трубки все более отдаляется (до определенного момента) от ее генеративного ядра. Феномен, показанный на рис. 1, на наш взгляд, свидетельствует о том, что в пыльцевых трубках обыкновенного можжевельника на каких-то этапах их развития между ядром клетки трубки и генеративным ядром нельзя исключить возможного существования редокс-сигнальной связи. Не исключено, что такая связь может активироваться белками ядерных мембран. Это косвенно подтверждается тем, что в пыльцевых трубках можжевельника нами обнаружен белок серин/треонин-протеинкиназа, относящийся к семейству фосфатидилинозитол 3-киназ-родственных протеинов киназы, а также ряд белков, принадлежащих к суперсемейству с активностью фосфогидролазы (HD домен-содержащий протеин, металл-зависимая фосфогидролаза), которые функционально способны участвовать в работе АФК-зависимых сигнальных систем.
3.3. Ядерный гаметофит
В нуклеарном гаметофите обнаружены два белка, играющих, на наш взгляд, важную роль в синхронизации свободно-ядерных делений (спермидинсинтаза, осуществляющая биосинтез спермидина, необходимого для синхронизации и регуляции биологических процессов путем поддержания мембранного потенциала и контроля внутриклеточного pH) и распознавании и сохранении свободных ядер в экстрацеллюлярном матриксе (протеоглюкан-4). Здесь также наблюдается значительное разнообразие ферментов, катализирующих метаболизм и биосинтез аминокислот, в том числе триптофана (триптофан синтаза). Сигналинг внутри нуклеарного гаметофита осуществляется за счет белков внутриклеточных кальциевых каналов и, вероятно, ферментов, катализирующих реакции окисления-восстановления с выделением АФК (алкоголь оксидаза). В передаче сигнала через стенку мегаспорангия в клетки нуцеллуса, вероятно, принимают участие транс-мембранные (глюкозилтрансфераза) и мембранно-связанные (глутамил аминопептидаза) белки.
3.4. Клеточный гаметофит (до оплодотворения)
Мегаспорангий на целлюлярной стадии вместе с формирующимися архегониальными комплексами имеет сложный состав белков, с трудом поддающийся анализу. В целлюлярном гаметофите обнаружен фермент 8-амино-7-оксононаноат синтаза, участвующий в метаболизме биотина, необходимого для биосинтеза белков и жиров в клетках формирующегося эндосперма (этот же фермент идентифицирован и в пыльцевых трубках), а также большое разнообразие ферментов, участвующих в метаболизме и синтезе аминокислот, жирных кислот, углеводов, липидов. Здесь выявлены белки, участвующие в делении клеток и во внутриклеточных сигнальных путях (дедикаторы цитокинеза), транспортные белки (АДФ/АТФ-транслоказы, оксистерол связанные протеины, специфичные каналы транс-мембранного переноса белков), ферменты, катализирующие гликолиз-синтез инозитола (УДФ-глюкозо 4-эпимераза). В клеточном гаметофите обнаружено большое разнообразие внутриклеточных сигнальных белков: металл-зависимые фосфогидролазы, внутриклеточные кальциевые каналы, ферменты, катализирующие реакции с выделением АФК (алкоголь оксидаза, фосфорибозилформилглицинамидин цикло-лигаза, супероксид дисмутаза), а также мембранно-связанных белков (глутамил аминопептидаза, гистидин киназа, фосфотирозин). Коинтеграторы активации сигналов, возможно, участвуют в оогенных процессах на ранних стадиях, а также в работе рецепторов спермодермы, воспринимающих сигналы извне (из клеток нуцеллуса) и передающих их внутрь мегаспорангия
3.5. Клеточный гаметофит (после оплодотворения)
Здесь, прежде всего, следует отметить присутствие таргетинговых протеинов, обеспечивающих сортировку и белковый трафик как внутри клетки, так и за ее пределы, а также фактора топологической специфичности клеточного деления, который противодействует активности ингибитора деления в срединном участке деления клеток. Весьма вероятно, что присутствие этих белков способствует интенсивному делению клеток формирующегося эндосперма и питанию развивающегося эмбриона.
3.6. Семязачатки на стадии профазы I мейоза макроспороцитов
Здесь выявлены белки, играющие важную роль в процессах мейоза: репликационный протеин А, предотвращающий повреждение одноцепочечной ДНК, и хроматин-ремодулирующий комплекс АТФазы, индуцирующий реакцию клетки на повреждение ДНК. Кроме того, здесь обнаружены белки, обеспечивающие транс-мембранный перенос как внутри клетки (молекулярные шапероны), так и вне ее (белки транслоказной системы). Как и в других эмбриональных тканях, в семязачатках на стадии мейоза присутствуют ферменты, участвующие в метаболизме и биосинтезе аминокислот и белков (цистеин--тРНК лигаза, глицерол-3-фосфат дегидрогеназа [НАД(Ф)+]), а также белки широкого спектра биосинтетических реакций (цитохромы P-типа).
Соотношение классов ферментов в разных эмбриональных тканях у можжевельника примерно одинаково, и составляет, в среднем: оксидоредуктазы – 23%, трансферазы – 17%, гидролазы – 25%, лиазы – 10%, изомеразы – 7%, лигазы – 15%, транслоказы – 3%, хотя сам состав ферментов в них различается, иногда существенно. Во всех исследованных тканях присутствуют белки доменов универсальных стрессовых белков, регуляторов отклика и ABC транспортеров (экспортеров) (не идентифицированы), а также рибосомальные белки.
3.7. Опылительная капелька
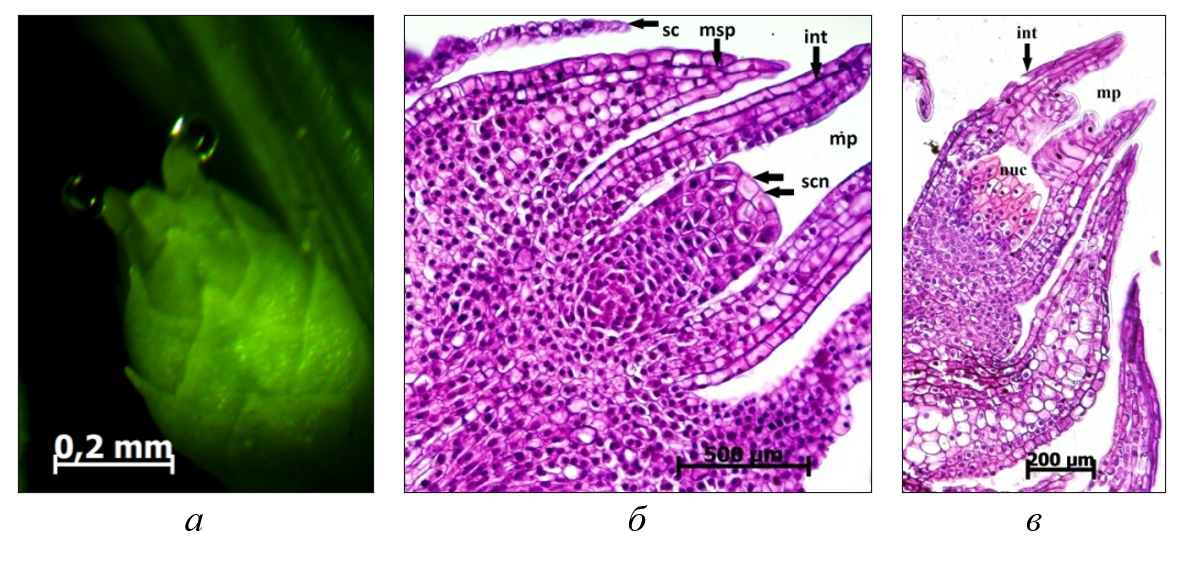
Рисунок 2 - Механизм опыления у можжевельника. Макростробил, семязачатки с опылительными капельками, общий вид (а) и семязачаток в разрезе (б) второго года развития непосредственно перед опылением, семязачаток вскоре после опыления (в):
int – интегумент; nuc – нуцеллус; mp – микропиле; sc – покровные чешуи семязачатка; msp – мегаспорофилл; scn – секреторные клетки нуцеллуса
Сразу после опыления секреторная жидкость вместе с пыльцой втягивается внутрь семязачатка через микропилярный канал. Пыльцевые зерна, оказавшись на апексе нуцеллуса, сбрасывают экзину и прорастают в пыльцевую трубку. Сразу после опыления микропилярный канал семязачатка в субнуцеллярной зоне почти полностью смыкается вследствие поперечного вытягивания клеток, слагающих внутреннюю поверхность интегумента (рис. 2в).
4. Заключение
Проведенные нами комплексные исследования экссудационного секрета различными хроматографическими методами указывают на его сложный химический состав. В составе летучих фракций органических соединений опылительной капельки можжевельника выявлено около 40 веществ, принадлежащих к различным классам. В состав сахаров входят всего два моносахарида: глюкоза (65,8%) и галактоза (34,2%). В составе аминокислот преобладают L-аргинин (25,5%), L-аспарагиновая (20,7%) и L-глутаминовая (15,1%) кислоты.
Опылительная капелька у можжевельника является многофункциональной. Она служит не только для улавливания и транслокации пыльцевых зерен, но и участвует в процессах узнавания, предотвращает преждевременное сбрасывание экзины, ингибирует развитие микрофлоры и способствует прорастанию пыльцы. Опылительная капелька реагирует на внешние раздражители. Эта реакция является избирательной, что подтверждается результатами экспериментов по искусственному опылению в лабораторных условиях , .
Можно предположить, что экссудационный секрет является квазиживой внеклеточной субстанцией, поскольку обладает рядом признаков, свойственных живым субъектам: раздражимостью и способностью считывать, кодировать и передавать биологически значимую информацию. В его белковом составе выявлены ДНК-зависимая РНК-полимераза, синтезирующая РНК из матрицы ДНК, фактор рециркуляции рибосом (RRF), а также репликационный белок А (RPA), участвующий в профазе I мейоза.
