Формирование коллекции образцов люцерны синей (Medicago sativa L. subsp. sativa) для создания транскриптомной карты
Формирование коллекции образцов люцерны синей (Medicago sativa L. subsp. sativa) для создания транскриптомной карты
Аннотация
Люцерна (Medicago sativa L.) — одна из наиболее ценных кормовых культур, сочетающая в себе высокие питательные качества и широкую адаптивность к условиям произрастания. Сложная автотетраплоидная структура её генома ограничивает эффективность традиционной селекции и усложняет молекулярно-генетический анализ. Современные тетраплоидные сборки генома открывают возможности для построения транскриптомной карты, которая представляет собой ценный ресурс для функциональной геномики растений, характеризующий экспрессию генов в различных органах и тканях на разных стадиях развития. В данной работе сформирована репрезентативная коллекция из 87 точек, охватывающих 30 тканей и органов, различающихся по морфологическим и физиологическим характеристикам, на восьми стадиях развития от прорастания до цветения и плодоношения. Отработан протокол выделения высококачественной РНК из разнообразного растительного материала люцерны. Полученная коллекция является основой для создания детализированной транскриптомной карты люцерны. Такая карта позволит проводить функциональный анализ генов, выявлять тканеспецифичность их экспрессии и идентифицировать молекулярные маркеры для геномной селекции.
1. Введение
Люцерна (Medicago sativa L.) — многолетняя культура семейства бобовые, входящая в число наиболее значимых кормовых растений мира . Высокий уровень сырого белка (16–24%) с оптимальным аминокислотным составом, продуктивное долголетие, многоукосность и широкая адаптивность к условиям произрастания — основные аспекты, определившие её популярность , . Кроме того, она играет важную роль в устойчивом земледелии благодаря своей способности фиксировать атмосферный азот через симбиоз с клубеньковыми бактериями, что снижает зависимость от части минеральных удобрений , .
Несмотря на её длительное возделывание людьми, улучшение продуктивности люцерны не так заметно, как у других культур . Сложная автотетраплоидная структура генома (2n = 4x = 32) ограничивает не только традиционную селекцию M. sativa L., но и применение молекулярных методов . Тетрасомный тип наследования и случайное бивалентное спаривание гомологичных хромосом затрудняет выявление и закрепление полезных признаков . Сдвиг в изучении этой культуры произошёл относительно недавно и был связан с публикацией её первого тетраплоидного генома . Это событие стало возможным благодаря развитию технологий секвенирование третьего поколения , .
За последние годы опубликованы ещё несколько сборок , последняя из которых вышла совсем недавно . Эта работа существенно расширяет возможности для современных геномных исследований данного вида. Наличие качественного референсного генома открывает дорогу не только для аннотации генов, но и для анализа их экспрессии, в том числе посредством создания транскриптомной карты.
Транскриптомная карта представляет из себя атлас экспрессии генов в различных тканях и органах организма на разных стадиях развития, часто при различных условиях среды. Данные, которые можно получить из такой карты, разнообразны: установление функций генов, выявление ключевых регуляторных факторов, изучение механизмов ответов на стрессы (засуха, затопление, фитопатогены), обнаружение тканеспецифичных паттернов экспрессии генов , . Подобные исследования уже опубликованы для таких культур как гречиха , томат , рис , арабидопсис , но тем не менее для большинства важных для сельского хозяйства растений они отсутствуют.
Для создания представительной и точной транскриптомной карты необходимо выполнение как минимум трёх условий, а именно: доступ к высококачественному референсному геному, наличие коллекции образцов, репрезентативно покрывающей различные органы и ткани на разных стадиях развития, и, наконец, протокол, обеспечивающий успешное выделение РНК с высокой степенью целостности — RNA integrity number (RIN) ≥7,0 .
По состоянию на конец 2025 года первое условие можно считать выполненным, доступно уже несколько геномных сборок , , . Однако два других пункта ещё получают своё развитие. Большинство опубликованных работ ограничиваются исследованием отдельных органов (листья, корни), часто без строгой привязки к стадиям онтогенеза, а формирование полноценных коллекций требует строгой стандартизации многих условий , . Получение высококачественной РНК из тканей люцерны, богатых полисахаридами, фенольными соединениями и активными РНКазами затруднено , . Эти факторы ограничивают выбор коммерческих протоколов для выделения РНК и иногда требуют их модификаций.
Цель данной работы — сформировать репрезентативную коллекцию образцов люцерны синей (M. sativa L. subsp. sativa) сорта Mulfeuil и отработать подход для выделения РНК высокого качества с применением коммерческих наборов реактивов для последующего создания транскриптомной карты.
2. Методы и принципы исследования
2.1. Выращивание люцерны
Семена люцерны синей (Medicago sativa L. subsp. sativa) сорта Mulfeuil, полученные из Всероссийского института генетических ресурсов растений им. Н.И. Вавилова, подвергали предварительной скарификации и сразу высевали в почву. Растения выращивали в контролируемых условиях при температуре 18–22°С, относительной влажности 60–70% и искусственном освещении (16 ч день / 8 ч ночь) с регулярным поливом.
2.2. Сбор материала
Для формирования коллекции образцов жизненный цикл люцерны первого года жизни разбили на 8 стадий (без учёта покоящихся семян). В соответствии с морфологическими и биологическими особенностями на каждой стадии отбиралось определённое количество постоянных и временных органов/тканей. Для каждой точки было собрано два биологических повтора, каждый из которых включал объединённую выборку органов/тканей собранных с пяти растений, за исключением некоторых точек. Для сбора верхушки побега на ранних стадиях онтогенеза в пул отбирали материал не с 5, а с 10 растений. Объединение под одной повторностью сразу нескольких генотипов позволяет снижать влияние внутрисортовой биологической вариабельности и выбросов на результаты будущих анализов.
Чтобы исключить влияние циркадных ритмов, сбор всех образцов осуществляли в одинаковый временной интервал (середина светового дня). Большинство отобранных проб немедленно замораживали в жидком азоте с последующим хранением при температуре -70°C. Небольшие органы/ткани предварительно помещали в лизирующий буфер из набора для выделения РНК Quick-RNA MiniPrep Kit (Zymo Research, США) с добавлением четырёх керамических шариков диаметром 2,8 мм, после чего также подвергали замораживанию в жидком азоте и убирали на хранение при температуре -70°С.
2.3. Выделение РНК
Экстракцию РНК проводили с использованием двух наборов: HiPure Plant RNA Mini Kit (Magen, Китай) для большинства отобранных тканей и органов и Quick-RNA MiniPrep Kit (Zymo Research) для малых и труднособираемых образцов. Коллекция органов и тканей, выделяемая основным набором (Magen), была предварительно измельчена в тонкодисперсный порошок одноразовым пестиком, закреплённым в аккумуляторной дрели-шуруповёрте DF332D (Makita, Япония) в пробирках объёмом 1,5 мл. Во избежание размораживания дробление материала проходило на низких оборотах в ванночках с жидким азотом. Для дополнительной защиты от воздействия РНКаз вместе с лизирующим буфером RLC из набора Magen использовали RNase Inhibitor (Servicebio, Китай). Образцы, замороженные в лизирующем буфере из набора Zymo Research с керамическими шариками, гомогенизировали с использованием прибора Homogenizer D6 (Servicebio, Китай) в течение 40 секунд на скорости 7 м/с.
Оценка полученных концентраций производилась с помощью флуориметра Qubit 4 (Thermo Fisher Scientific, США), а качество и целостность РНК определялась по значениям RINc использованием системы капиллярного электрофореза 2100 Bioanalyzer (Agilent Technologies, США). До проведения последующих анализов все выделенные образцы хранились при -70°C.
3. Основные результаты и обсуждение
3.1. Выборка образцов растительного материала для создания транскриптомной карты
Создание информативной транскриптомной карты организма, охватывающей максимально возможное число антатомически и функционально различных тканей, существенно повышает качество аннотации генов. Мультистадийный и многотканевый охват позволяет лучше выстраивать полноценные сети коэкспрессии генов и выявлять гены с ранее неизвестными функциями, включая связанные с ответом на стрессы . Недостаточная репрезентативность, напротив, ограничивает разрешающую способность анализа: тканеспецифичные сигналы могут маскироваться экспрессией преобладающих типов клеток при исследовании смешанного материала .
Сформированная нами коллекция образцов охватывает основные стадии онтогенеза M. sativa L. subsp. sativa, начиная от семян в состоянии покоя и заканчивая цветением с плодоношением (рис. 1). Разбиение ювенильной стадии сразу на несколько (рис. 1а–1д) может показаться избыточным, однако такое детализированное деление выбрано сознательно. Такой подход обеспечивает высокое разрешение при анализе динамики экспрессии генов в условиях интенсивного роста с быстрой морфогенетической перестройкой молодых растений. Появляется возможность выявлять критические окна функционирования ключевых путей регуляции.

Рисунок 1 - Коллекция образцов люцерны синей (Medicago sativa L. subsp. sativa) сорта Mulfeuil, собранная для создания транскриптомной карты
Примечание: стадии развития: а – прорастание, б – выход семядолей, в – появление круглого листа, г – два тройчатых листа, д – пять тройчатых листьев, е – активный рост, ё – бутонизация, ж – цветение и плодоношение. Ткани и органы отбираемые для анализа: 1 – семя в состоянии покоя, 2 – набухшее семя, 3 – проросшее семя на 3 день, 4 – главный корень, 5 – боковой корень, 6 – корневая шейка, 7 – гипокотиль, 8 – семядоли, 9 – эпикотиль, 10 – круглый лист, 11 – второе междоузлие, 12 – прилистники, 13 – зрелый лист, 14 – молодой лист, 15 – нераскрывшийся лист, 16 – черешок листа, 17 – центральное междоузлие, 18 – последнее междоузлие, 19 – верхушка стебля, 20 – бутон, 21 – ось соцветия, 22 – цветоножка, 23 – цветок, 24 – лепестки, 25 – чашечка, 26 – плодолистик, 27 – тычиночная нить, 28 – пыльники, 29 – боб в зелёной спелости, 30 – боб в жёлтой спелости. Вклад стадий в общее число образцов (87): а – 3, б – 6, в – 4, г – 9, д – 13, е – 13, ё – 15, ж – 24
Общее число сборов растительного материала по всем учитываемым нами этапам онтогенеза достигло 87 уникальных точек, каждая из которых была отобрана в период её морфологической активности. Для обнаружения плавной смены градиента экспрессии корневой системы и переходных зон отбирались главный и боковые корни, корневая шейка, гипокотиль и эпикотиль. Вегетативные органы представлены листьями на разных стадиях развития (семядоли, круглый лист, молодые, развивающиеся и зрелые листья), черешками, прилистниками и стеблем на разном уровне (второе, центральное, последнее междоузлие и верхушка). Репродуктивные органы охватывают все элементы цветка, начиная от бутонов и продолжая отдельными компонентами соцветия (ось и цветоножка) к частям цветка (чашечка, лепестки, тычинки, плодолистик и пыльники) и бобам (зелёная и жёлтая спелость).
3.2. Результаты выделения РНК
Качество и количество выделяемой РНК напрямую зависит от выбранного метода экстракции и точности выполнения процедур. Выдерживание строгой стандартизации является необходимым условием для получения надёжных результатов.
На этапе отработки протокола выделения РНК из растений люцерны использованы образцы, собранные в разные стадии развития. В ходе эксперимента установлено, что наборы HiPure Plant RNA Mini Kit (Magen) и Quick-RNA MiniPrep Kit (Zymo Research) позволяют получить тотальную РНК высокого качества (показатель RIN составил от 7,4 до 8,1). При этом набор HiPure Plant RNA Mini Kit (Magen) был эффективен для выделения РНК из большинства образцов, за исключением образцов, имеющих небольшой размер, для которых лучшие результаты показал набор Quick-RNA MiniPrep Kit (Zymo Research). Электрофореграммы РНК представлены на рисунке 2. Все образцы демонстрируют высокую целостность РНК с хорошо различимыми пиками рибосомной РНК, отсутствием выраженного фонового шума и деградации.
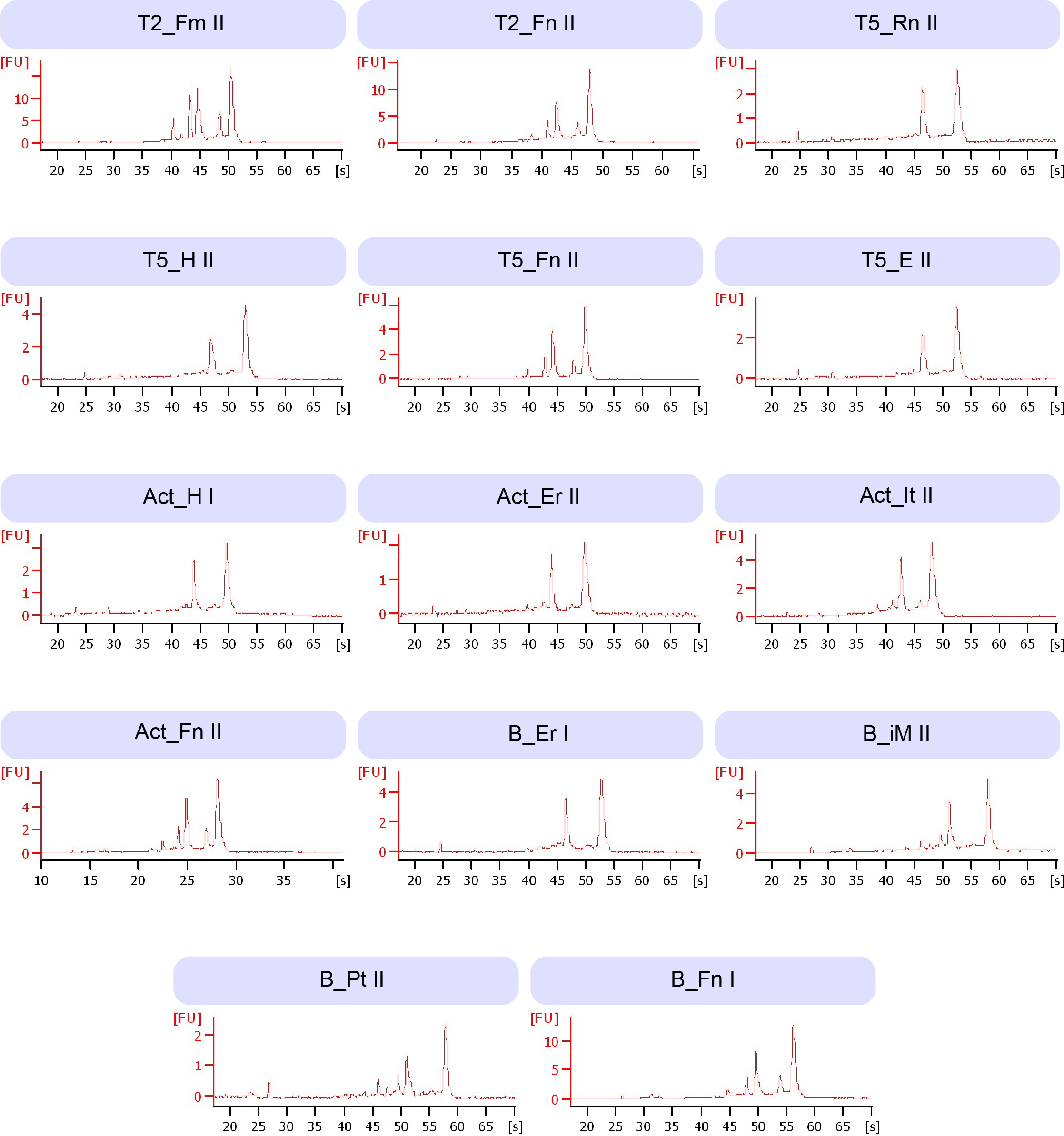
Рисунок 2 - Панель электрофореграмм, полученных на приборе Bioanalyzer 2100 (Agilent Technologies) для оценки качества РНК, выделенной из органов/тканей люцерны синей на разных стадиях развития
Примечание: первая часть шифра относится к стадиям: T2 – два тройчатых листа, Т5 – пять тройчатых листьев, Act – активный рост. Вторая часть соответствует органу/ткани: Rn – корневая шейка, H – гипокотиль, E – эпикотиль, Er – второе междоузлие, iM – среднее междоузлие, iT – последнее междоузлие, Pt – черешок листа, Fm – молодой лист, Fn – нераскрывшийся лист. Римские цифры обозначают повторность: I – первая, II – вторая
4. Заключение
Нами описано формирование коллекции образцов растительного материала люцерны синей (Medicago sativa L. subsp. sativa), необходимой для создания представительной транскриптомной карты. Объяснён принцип выделения точек и системы сбора растительного материала, охватывающего 8 стадий развития с 30 типами разных органов и тканей. Также отработана методика выделения высококачественной РНК с применением двух коммерческих наборов. Полученные результаты позволят создать детальную карту экспрессии генов люцерны и получить высококачественную аннотацию генома этой ценной кормовой культуры.
