ИЗУЧЕНИЕ РЕАКЦИИ ЯРОВОЙ ПШЕНИЦЫ НА ТРОПИЛИРОВАННЫЙ АЗОМЕТИН ПО ИЗМЕНЧИВОСТИ ПАРАМЕТРОВ ПРОРОСТКОВ
ИЗУЧЕНИЕ РЕАКЦИИ ЯРОВОЙ ПШЕНИЦЫ НА ТРОПИЛИРОВАННЫЙ АЗОМЕТИН ПО ИЗМЕНЧИВОСТИ ПАРАМЕТРОВ ПРОРОСТКОВ
Аннотация
Высокая зараженность семенного материала заставляет ученых разрабатывать новые препараты, обладающие одновременно обеззараживающим и стимулирующим эффектом. Азометины представляют особый интерес, так как они в малых количествах позволяют подавлять патогенную микрофлору и в то же время проявляют ростовую активность сельскохозяйственных культур. Цель исследований – отработать новый подход к синтезу N-арилметилен-4-(7-циклогепта-1,3,5-триенил)анилинов и установить возможность использования тропилированного азометина на яровой пшенице в качестве регулятора роста. В статье представлены новые подходы к синтезу тропилированных азометинов, позволяющие получать больший выход химически чистых синтезированных веществ. В модельном лабораторном опыте изучено действие N-2-гидроксифенилметилен-41-(7-циклогепта-1,3,5-триенил)анилина на проростки яровой пшеницы сорта Иргина.
1. Введение
Препараты, применяемые в аграрном секторе, обеспечивают: во-первых, защиту от патогенной микрофлоры; во-вторых, регулирование роста и развития растений, в-третьих, улучшение качества продукции
, . Используемые вещества могут носить как биологический, так и химический характер получения. Последние синтезируют с использованием широкого спектра химических соединений и различными подходами. Среди органических веществ интерес представляют биологически значимые гетероциклы – азометины , . Среди азометинов, N-арилметилен-4-(7-циклогепта-1,3,5-триенил)анилины, могут быть интересны как росторегуляторы. Синтез тропилированных азометинов можно осуществлять разными способами , тем не менее, нет универсального метода, каждый метод сопровождается рядом особенностей. Действия препаратов и вновь синтезированных веществ оценивают по биологической эффективности, и, в частности, фитотестировании на высших растениях. Устанавливают изменение морфометрических и биохимических параметров под действием испытуемых веществ , , .Цель исследований – отработать новый подход к синтезу N-арилметилен-4-(7-циклогепта-1,3,5-триенил)анилинов и установить возможность использования тропилированного азометина на яровой пшенице в качестве регулятора роста.
2. Методы и принципы исследования
Отработка новых подходов к синтезу тропилированных азометинов, обладающих антимикробной и биологической активностью, проведена в лаборатории кафедры экологии и химических технологий Института фундаментальных и прикладных агроэкобиотехнологий и лесного хозяйства ФГБОУ ВО ПГАТУ. Тестирование наиболее интересного N-2-гидроксифенилметилен-41-(7-циклогепта-1,3,5-триенил)анилина (рис. 1) проводили на высших растениях в лаборатории кафедры агрохимии и почвоведения Института фундаментальных и прикладных агроэкобиотехнологий и лесного хозяйства ФГБОУ ВО ПГАТУ.
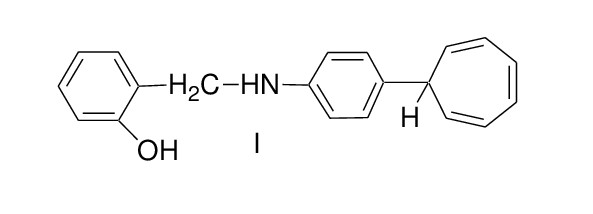
Рисунок 1 - N-2-гидроксифенилметилен-41-(7-циклогепта-1,3,5-триенил)анилина
3. Основные результаты
Значительный интерес и практическое значение представляет реакция тропилирования азометинов солями тропилия (перхлоратом или тетрафторборатом). Этот способ можно назвать классическим. При взаимодействии эквимолярных количеств исходных реагентов в среде этанола были выделены N-арилметилен-4-(7-циклогепта-1,3,5-триенил)анилины. Выход целевых продуктов не сильно зависит от соли тропилия или заместителей в альдегидном фрагменте азометинов, а зависит от времени протекания реакций. С помощью тонкослойной хроматографии было определено, что целевые продукты образуются в течение часа, однако препаративно выделить их не удалось. Время реакции составляло 3 часа, по истечении времени выделились целевые продукты с удовлетворительным выходом (рис. 2).
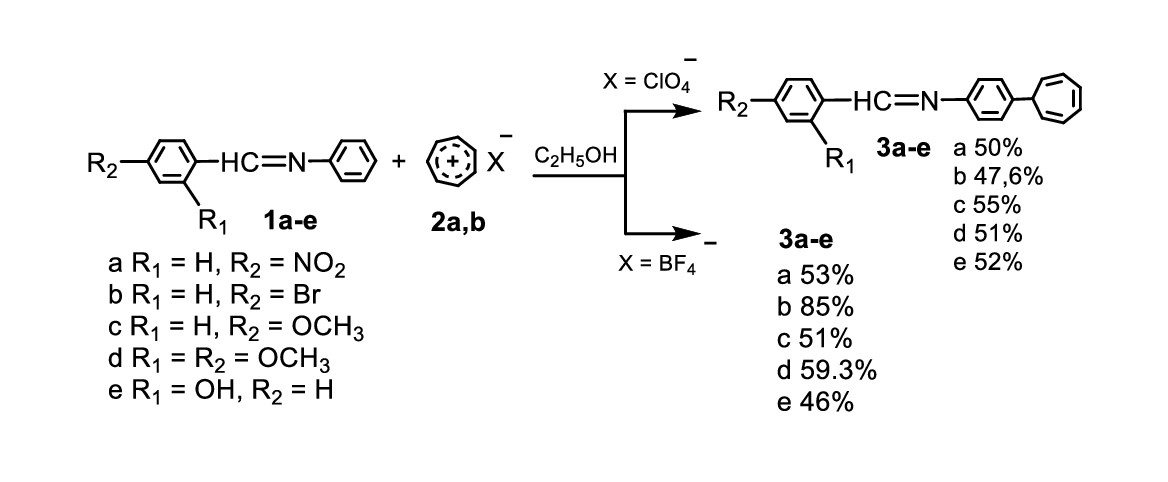
Рисунок 2 - Тропилирование азометинов солями тропилия
Ранее в наших исследованиях установлена микробиологическая эффективность N-2-гидроксифенилметилен-41-(7-циклогепта-1,3,5-триенил)анилина. В настоящей статье рассмотрим возможность использования указанного вещества в качестве регулятора роста на яровой пшенице.
Исследованиями установлено, что испытуемое вещество не оказало влияние на энергию прорастания и всхожесть семян пшеницы, они были на уровне контроля и составили соответственно 87,6-88,0 и 86,6-87,8 %.
Обработка семян раствором тропилированным азометином привела к изменению биометрических и биохимических параметров растений пшеницы (табл.).
Таблица 1 - Влияние тропилированного азометина на морфометрические и биохимические параметры проростков яровой пшеницы
Признаки | Варианты | HCP05 | |||||
Контроль | 1×10-5 % | 1×10-4 % | 1×10-3 % | 1×10-2 % | |||
Высота растений, см | 24,3±0,9* | 24,7±0,3 | 24,7±1,0 | 27±0,3** | 25,1±0,4 | 0,9 | |
Воздушно-сухая масса, мг | ростки | 380±30 | 230±20 | 260±30 | 200±10 | 180±10 | 30 |
корни | 480±10 | 250±10 | 330±10 | 400±30 | 690±10 | 60 | |
Содержание растворимого белка, % | ростки | 7,5±0,1 | 14,9±0,2 | 12,4±0,6 | 13,6±0,4 | 14,4±0,2 | 0,5 |
корни | 4,1±0,1 | 15,9±0,3 | 14,2±0,1 | 13,1±0,2 | 9,0±0,1 | 0,2 | |
Содержание фосфора, % | ростки | 6,5±0,1 | 3,7±0,0 | 2,7±00 | 4,4±00 | 9,9±0,1 | 0,1 |
корни | 2,1±0,0 | 2,1±00 | 1,4±00 | 1,7±00 | 1,7±00 | 0,0 | |
Содержание калия, % | ростки | 2,5±00 | 3,5±00 | 3,9±00 | 3,1±00 | 2,2±00 | 0,0 |
корни | 1,3±0,1 | 1,6±0,3 | 1,2±0,1 | 1,1±0,1 | 1,0±0,1 | 0,1 | |
Примечание: 24,3±0,9* – среднее значение признака ± ошибка среднего; 27,3±0,3** – статистически достоверные различия при р < 0,05
Математически доказанно удлинение растений относительно контроля на вариантах с концентрацией раствора 1×10-2 и 1×10-3 %, прибавка составила соответственно 3,3 и 12,3%. Дальнейшее разведение растворов азометина не влияло на высоту растений, изменения находились в пределах ошибки среднего. На накопление массы в ростках пшеницы испытуемые концентрации азометина не оказали положительного влияния. Максимальная убыль в весе по сравнению с контролем отмечена на варианте с концентрацией азометина 1×10-2 % и составила 52,6%. Замачивание семян пшеницы в растворах азометина 1×10-5-1×10-3 % оказало негативное воздействие на развитие зародышевых корней. Убыль в массе на указанных вариантах относительно контроля составила 16,7-47,9%. При использовании азометина в концентрации 1×10-2 % произошло увеличение массы корней на 210 мг. Корреляционный анализ показал высокую взаимосвязь между концентрацией растворов и массой корней, коэффициент корреляции составил 0,970.
Анализ растительных образцов показал, что N-2-гидроксифенилметилен-41-(7-циклогепта-1,3,5-триенил)анилин оказал неоднозначное влияние на биохимические параметры проростков яровой пшеницы (табл.). Замачивание семян в растворах обеспечило положительное изменение содержания растворимого белка как в ростках, так и в корнях проростков. Увеличение относительно контроля составило в ростках на 65,3-98,7%, в зародышевых корнях – 119,5-287,8 %. Максимальный уровень белка как в ростках, так и в корнях наблюдался на варианте с минимальной концентрацией тропилированного азометина. Отмечена математически доказанная обратная корреляционная зависимость между концентрацией испытуемого раствора и содержанием растворимого белка в корнях (r = -0,947). Содержание фосфора в ростках и корнях проростков пшеницы на вариантах с испытуемым раствором уменьшалось относительно контроля на 32,3-58,5 и 19,0-33,3% соответственно. Четкой зависимости между концентрациями тропилированного азометина и уровнем фосфора в проростках не наблюдалось. Обработка семян растворами азометина в концентрациях 1×10-5-1×10-3 % привела к увеличению содержания калия в ростках пшеницы, прибавка относительно контроля составила 1,0-1,4%. Установлена обратная очень тесная корреляционная зависимость между концентрацией азометина и содержанием калия в ростках (r = -0,924). На содержание калия в корнях проростков азометин положительно повлиял только при обработке семян самым разбавленным раствором, увеличение относительно контроля составило на 23,1%. При использовании более концентрированных растворов происходит уменьшение уровня калия в корнях, убыль составила 0,1-0,3%.
4. Заключение
Предложенный подход к синтезу дает возможность получить тропилированные азометины с более существенным выходом, чем это было в ранее изученных методах. Замена растворителя тетрагидрофурана, на менее токсичный – этанол, позволяет получать чистые соединения без дополнительных методов очистки. Результаты модельного опыта показали, что обработка семян яровой пшеницы концентрацией N-арилметилен-4-(7-циклогепта-1,3,5-триенил)анилина 1×10-2% оказывает положительное влияние на высоту растений и массу корней. Дальнейшее разбавление раствора оказывает неоднозначное влияние на растения.
